mahsabanoo
عضو جدید
سلام دوستان میخوام یسری مقاله مرتبط با پایان نامه خودم پیدا کنم ولی هر جی سرچ میکنم نامرتبط هست کسی میتونه کمکم کنه
سلام دوستان میخوام یسری مقاله مرتبط با پایان نامه خودم پیدا کنم ولی هر جی سرچ میکنم نامرتبط هست کسی میتونه کمکم کنه
سلام یه سوال داشتم:
دلیل اینکه وقتی ماده فلورسنت رو میتابونند، صفحه اون سمتی که پرتو خارج میشه باید بزرگتر باشه (واگرا) چیه؟ فکر میکنم مربوط به شیمی دبیرستان میشد اما اصلا تو خاطرم نیست.
ممنون میشم اگر کسی راهنمایی کنه.
درود بر شماسلام یه سوال داشتم:
دلیل اینکه وقتی ماده فلورسنت رو میتابونند، صفحه اون سمتی که پرتو خارج میشه باید بزرگتر باشه (واگرا) چیه؟ فکر میکنم مربوط به شیمی دبیرستان میشد اما اصلا تو خاطرم نیست.
ممنون میشم اگر کسی راهنمایی کنه.
مشاهده پیوست 246936مشاهده پیوست 246937
ممنون، بله حق با شماست، فکر میکنم این عکس ها مساله رو روشن میکنه

سلام به همگی
دوستان یه سوال داشتم
میخوام میزان توتال فسفات و اورتو فسفات در یک محلول که حاوی فسفات هستش
رو اندازه گیری کنم، از چه روشی باید استفاده کنم؟
از روشی که برای اندازه گیری میزان فسفات برای نمونه های حاوی فسفات هستش
استفاده کردم (ASTM) ولی چون نمونه حاوی ذرات معلق زیادی هستش با رقت های متفاوت نتایج
متفاوتی بدست میارم...
خوشحال میشم کمک کنید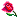
کسی نیست جواب منو بده؟؟؟؟
با سلام
دوستان درباره كسى اطلاعاتى داره منو راهنمايى كنه
Electrode conditioning
مشاهده پیوست 249251
سلام و خسته نباشید... این عکس توی یه مقاله بود... یه سوال واسم پیش اومده... با توجه به جهت فلش ، آیا ممکنه که یون کروم یه بخش از اون ترکیب رو جدا کنه و تشکیل کمپلکس بده؟
 )
)مشاهده پیوست 249251
سلام و خسته نباشید... این عکس توی یه مقاله بود... یه سوال واسم پیش اومده... با توجه به جهت فلش ، آیا ممکنه که یون کروم یه بخش از اون ترکیب رو جدا کنه و تشکیل کمپلکس بده؟
سلام دوست عزیز.سلام دوستان
میخاستم بدونم معادله ای وجود داره که توسط اون بتونیم مدت زمانی که یک ماده جامد نیاز داره تا ذوب بشه رو تعیین کنیم؟
ممنون
سلامسلام....
ممنون میشم اگر کسی بتونه در مورد ساختن بافری از آمونیوم در pH 4-4.5 منو راهنمایی کنه...خیلی ضروریه...
سلام....محلول من آمونیوم سولفاته که باید در حین آزمایش pH در 4-4.5 باقی بمونه...نباید تغییر کنه...منم هر جی بافر از آمونیوم دیدم pH اونا بالای 7 بوده...نمیدونم چی کار کنم...ممنون میشم اگه کمکم کنید.....خیلی ضروریه..پایان نامم لنگه اینه..لطفا...

من که راه دیگه ای یادم نمیاد...اما شما حتما باید بافرتون رو با آمونیوم بسازید؟ با استات نمیشه؟تنها راهه ثابت نگه داشتن pH هم فقط بافره درسته...راهه دیگه ای هم نیست...
آره حتما این کارو انجام بدید.بله باید حتما آمونیوم باشه.
فکر کنم باید رو pH های بالاتر چند تا تست بزنم شاید جوابی بر خلاف داده های که بهشون رسیدم بگیرم...
فقط کتاب یا هر جیزی که در مورد بافرهای آمونیومی بحث کرده میتونید در اختیارم بزارید...واقعا ممنون میشم..
سلام بر دوستان من رشته ام شیمی نیست اما به مشکلی برخوردم که باید جواب سوال زیر رو بدونم ممنون میشم بنده رو راهنمایی کنید
یه لیتر آب داریم که با 700 گرم سدیم دی کرومات سیر شده
آیا توی این یه لیتر آب سیر شده ( بدون تغییر شرایط مثل دما) میشه سدیم سولفات هم حل کرد ؟
اگر نمیشه چرا ؟
و اگر میشه چرا و چقدر حدودا میشه حل کرد ؟
ممنون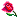
سلام...سوال جالبی بود. تا حالا بش فک نکرده بودم.
حلالیت سدیم دی کرومات 730-40 گرم در 1 لیتر آبه، حالا به فرض که اشباع شده باشه و دما هم تغییر نکنه، تا جایی که با همزدن بیشتر اصطلاحا خواص ماکروسکوپی محلول تغییر نکنه، در این حالت تعادل فاز جامد-مایع رو داریم، ینی دیگه فقط یون از سمت بلور به حلال نمیره، از سمت حلال به سمت بلورم میره (ترسیب). اینجا بر اساس اصل لوشاتلیه میشه گفت وقتی شما سدیم سولفات رو به محیط اضافه کنی، تعادل به سمت چپ برمیگرده و دیکرومات سدیمت دوباره شروع بع رسوب دادن میکنه البته به اندازه ای که سولفات سدیم حل بشه، مثلا اگه هم بزنی سدیم دی کرومات شروع به رسوب دادن میکنه سدیم سولفات حل میشه.
اینکه این چدیده ممکنه یه پدیده رقابتی بشه میتونه یه توجیح دیگه هم داشته باشه. یه پدیده ای هست به نام salting out که میان با افزایش یه جزء محلول تر، جزء نامحلول تر رو از محیط خارج میکنن، البته بیشتر برا خارج کردن درشت ملکول ها کاربرد داره. اما چون اینجا یون هامون سدیم و سولفاته که جفتشون تو رده بندی یونهای دارای اثر نمک جزو اولیا هستن ، در نتیجه میشه اینجوری گفت که با ورود سولفات سدیم، دی کرومات سدیم از محیط خارج میشه و رسوب میکنه.
کاش بچه ها بیان بحث کنیم در مورد این موضوع
ممنون بابت راهنماییتون
فقط فکر کنم برعکس گفتین طبق گفته تون :
یه پدیده ای هست به نام salting out که میان با افزایش یه جزء محلول تر، جزء نامحلول تر رو از محیط خارج میکنن
سدیم سولفات در دمای 25 درجه 300 گرمش در یک لیتر حل میشه در صورتی که در همین دما 730 گرم سدیم دی کرومات در یک لیتر آب حل میشه
ممنون بابت راهنماییتون
فقط فکر کنم برعکس گفتین طبق گفته تون :
یه پدیده ای هست به نام salting out که میان با افزایش یه جزء محلول تر، جزء نامحلول تر رو از محیط خارج میکنن
سدیم سولفات در دمای 25 درجه 300 گرمش در یک لیتر حل میشه در صورتی که در همین دما 730 گرم سدیم دی کرومات در یک لیتر آب حل میشه
| Thread starter | عنوان | تالار | پاسخ ها | تاریخ |
|---|---|---|---|---|
| A | سوالات المپیاد بین المللی شیمی از سال 1986 تا سال 2003 | شیمی | 1 | |
|
|
سوالات مربوط به تبدیل واحد | شیمی | 7 |
