مقدمه
مقدمه
گوگرد، عنصری از گروه A6 جدول تناوبی
گروه A6 جدول تناوبی در جدول مقابل نشان داده شده است. این گروه از عناصر کاملاً با زندگی ما آمیخته هستند. ما در هر لحظه برای زنده ماندن نیاز به اکسیژن داریم. آیا میدانستید که گوگرد نیز یکی از عناصر اصلی حیات است؟ گوگرد جزء اصلی ساختار برخی از پروتئینهای ارگانیسمهای زنده است. گوگرد در بسیاری از صنایع بکار گرفته میشود ولی انتشار گوگرد در محیط، اغلب به عنوان مشکل زیست محیطی مطرح میشود نه یک پدیده طبیعی. با افزایش عدد اتمی در جدول گروه A6، خاصیت فلزی نیز افزایش مییابد. عنصر پلونیوم هیچ ایزوتوپ پایداری نداشته و ایزوتوپ دارای عدد اتمی 209 دارای بیشترین میزان نیمه عمر در حدود 103 سال میباشد.
Group 6A Elements | | �
| Oxygen | O |
| Sulfur | S |
| Selenium | Se |
| Tellurium | Te |
| Polonium | Po |
خواص عنصر اکسیژن بسیار متفاوت از دیگر عناصر این گروه است ولی تمامی آنها2 الکترون در لایه اربیتال S و 4 الکترون در اربیتال p دارند که بصورت عمومی به شکل S[SUP]2[/SUP]P[SUP]4[/SUP] نوشته میشود. روند خواص عناصر این گروه جالب است و آشنایی با این روند در پیشبینی واکنش آنها با دیگر عناصر به ما کمک میکند. اکثر روندهای مذکور، در مورد تمامی گروههای جدول تناوبی مشابه است. این روندهای مشابه، بستگی زیادی به اندازه اتمها و تعداد الکترونهای هر اتم دارد. برخی از این روندها در زیر آورده شدهاند:
- خواص فلزی عناصر این گروه از بالا به پایین افزایش مییابد به نحوی که پلونیم اساساً یک فلز است. این عنصر توسط ماری کوری کشف شده و به افتخار سرزمین مادری وی، لهستان (Poland) نامگذاری شده است.
- الکترونگاتیوی، انرژی یونیزاسیون (یا پتانسیل یونیزاسیون) عناصر گروه با افزایش وزن اتمی، افزایش مییابد.
- در این گروه از بالا به پایین، شعاع اتمی و نقطه ذوب افزایش مییابد.
- به دلیل اندازه کوچک مولکول اکسیژن، خواص شیمیایی آن کاملاً با گوگرد متفاوت است. دیگر عناصر گروه، تشابه بشتری در خواص شیمیایی دارند.
گوگرد یک عنصر جامد شکننده بی بو ه رنگ زرد کمرنگ است که در آب نامحلول بوده ولی در دی سولفید کربن محلول است. گوگرد عنصری ضروری برای حیات بوده و به مقادیر کمی در چربیها، سیالات بدن و ساختار اسکلت وجود دارد.
در سال 1839، چارلز گودیر بطور تصادفی مخلوطی از لاستیک و گوگرد را درون آتش انداخت که منجر به کشف لاستیک ولکانیزه شد. وی لاستیک اختراعی خود را به احترام ولکان، خدای رومی آتش، نامگذاری نمود. در قرن هیجدهم، اغلب مادران انگلیسی به کودکان خود یک قاشق مخلوط گوگرد و شیره قند به عنوان تقویت کننده بهاری میخوراندند. امروزی داروهای حاوی گوگرد (داروهای سولفانیلامیدی) برای مقابله با باکتری عامل مننژیت استفاده میشوند. روغنهای گوگردی نیز برای معالجه عفونتهای پوستی استعمال میشوند.
تاریخچه گوگرد و استفاده از گوگرد به هزاران سال پیش باز میگردد. مصریهای باستان با استفاده از گوگرد رنگ میساختند و یا از آن برای سفیدکاری و رنگبری استفاده میکردند (بصورت SO[SUB]2[/SUB]). مردمان چین نیز از گوگرد برای ساختن باروت استفاده کردند. یونانیان باستان از گوگرد به عنوان دارو و ضد عفونی کننده استفاده کردهاند.
قسمت اعظم گوگرد تولیدی جهان برای تولید اسید سولفوریک (H[SUB]2[/SUB]SO[SUB]4[/SUB]) استفاده میشود. اسید سولفوریک تولیدی اغلب برای ساخت کودهای شیمیایی (نزدیک به 40 میلیون تن در سال)، باتریهای سرب-اسید و بسیاری از صنایع دیگر مورد استفاده قرار میگیرد. مقادیر کمی از گوگرد تولیدی جهان نیز برای ساخت لاستیکهای ولکانیزه، حشرهکشها (هومر، شاعر یونان باستان نزدیک 2800 سال پیش از گوگرد به عنوان آفتکش یاد کرده است)، باروت و رنگدانهها استفاده میشود.
گوگرد علاوه بر اسید سولفوریک میتواند ترکیبات جالب دیگر نیز ایجاد نماید. سولفید هیدروژن (H[SUB]2[/SUB]S) ترکیب گازی است که بوی تخم مرغ گندیده میدهد. دی اکسید گوگرد (SO[SUB]2[/SUB]) که حاصل سوختن گوگرد در هوا است به عنوان عامل رنگبر، حلال، ضد عفونی کننده و ماده سرد کننده مورد استفاده قرار میگیرد. اگر دی اکسید گوگرد با آب ترکیب شود تولید اسید سولفورو (H[SUB]2[/SUB]SO[SUB]3[/SUB]) میکند که اسید ضعیف بوده و جزء اصلی بارانهای اسیدی به شمار میرود.
گوگرد عنصری خالص بوی بسیار کمی دارد. بوی تخم مرغ گندیده که اغلب از گوگرد استشمام میشود در واقع ناشی از سولفید هیدروژن موجود در آن است. همچنین بوی خاص سیر، خردل، پیازها و کلم نیز ناشی از ترکیبات گوگردی موجود در آنها است. حتی بوی بسیار بد و ماندگاری که راسو برای دفاع از خود ساطع میکند، ناشی از ترکیبات گوگردی است. در واقع، گوگرد در تمامی بافتهای زنده یافت میشود. گوگرد در ساختار پروتئینهای گیاهی وجود داشته و از طریق تغذیه انسانها و حیوانات به ساختار بدنی آنها انتقال مییابد.
آیا میدانستید که؟
- گوگرد دهمین عنصر از نظر فراوانی در کهکشان راه شیری است. گوگرد در پوسته زمین، در اقیانوسها و حتی در شهاب سنگها یافت میشود.
- 55 درصد گوگرد تولیدی دنیا برای ساخت کودهای شیمیایی و 45 درصد باقیمانده برای تولید محصولات تجاری دیگر مورد استفاده قرار میگیرد.
- گوگرد در اغلب غذاها یافت میشود که از میان آنها میتوان به پیازها، تخم مرغ، کلمها و آرد سویا اشاره نمود.
- گوگرد در بدن اغلب موجودات مانند انسان، پرندگان و چهارپایان یافت میشود.
- به دلیل اشتعال آسان گوگرد، این عنصر در ساخت کبریت و مواد آتشبازی به وفور استفاده میشود. نام باستانی گوگرد (brimstone) نیز به معنی سنگی است که میسوزد.
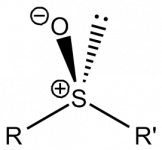
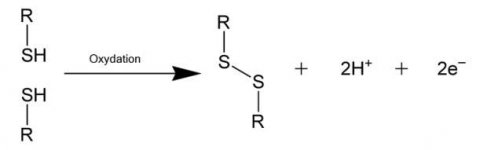
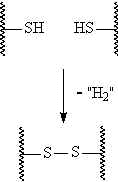
منابع تهیه این عنصر در دنیا شامل معادن گوگرد عنصری، معادن سولفیدی، سوختهای سولفیدی و سولفاتها میباشد. در کشور ما ایران نیز با توجه به منابع عظیم سوختهای فسیلی، سالانه مقادیر زیادی از این عنصر گرانبها از طریق بازیافت از منابع نفت و گاز تهیه میشود. این ترکیب از اجزای ساختاری مهم بسیاری از ترکیبات آلی و معدنی مانند انواع مرکاپتانها، تیوفنها، سولفیدها، پلیسولفیدها و سولفاتها و ... میباشد که هر کدام به نوبه خود کاربردهای مهمی را درصنایع مختلف شیمیایی، دارویی، غذایی و ... ایفاء میکنند.
برخی از ترکیبات مهم گوگرد عباتند از:
- sodiumdithionite, Na[SUB]2[/SUB]S[SUB]2[/SUB]O[SUB]4[/SUB] عامل کاهنده قوی
- sulfurous acid, H[SUB]2[/SUB]SO[SUB]3[/SUB] این ترکیب با حل کردن SO[SUB]2[/SUB] در آب بدست میآید. این اسید و سولفیدهای مرتبط با آن از کاهندههای نسبتاً قوی میباشند. ترکیبات دیگر بدست آمده از SO[SUB]2[/SUB] شاملPyrosulfite (یونS[SUB]2[/SUB]O[SUB]5[/SUB][SUP]2-[/SUP] ) میشود.
- thiosulfates (S[SUB]2[/SUB]O[SUB]3[/SUB][SUP]2-[/SUP]) که برای ثابت کردن عکسها بکار میرود، یک عامل اکسید کننده است. تیوسولفات آمونیم جایگزین سیانید در تصفیه خاک طلا میگردد.
- ترکیباتdithionic acid (H[SUB]2[/SUB]S[SUB]2[/SUB]O[SUB]6[/SUB])
- polythionic acids , (H[SUB]2[/SUB]S[SUB]n[/SUB]O[SUB]6[/SUB]) که در آن n از 3 تا 80 میتواند تغییر کند.
- سولفاتها، نمک اسید سولفوریک و نمک Epsom از سولفاتهای منیزیم میباشند.
- peroxymonosulfuric acid , peroxydisulfuric acids که هر دو از عملکرد SO[SUB]3[/SUB] درH[SUB]2[/SUB]O[SUB]2[/SUB] و H[SUB]2[/SUB]SO[SUB]4[/SUB] غلیظ شده حاصل میشوند.
- thiocyanogen (SCN)[SUB]2[/SUB]
- tetrasulfur tetranitride (S[SUB]4[/SUB]N[SUB]4[/SUB])