گاهی لازم است محلولی را که دارای PH معین است، تهیه و ذخیره کنیم. نگهداری چنین محلولی حتی مشکلتر از
تهیه آن است.
چنانچه این محلول در معرض هوا قرار بگیرد، دیاکسید کربن (یک انیدرید اسید) جذب میکند و اسیدیتر میشود.
چنانچه محلول در ظرف شیشهای ذخیره شود، ناخالصیهای قلیایی که در اثر خیسیدن شیشه شسته میشود، ممکن
است PH را تغییر دهد. در محلولهای بافر (تامپون) ، PH در رقمی تا حدودی ثابت ، حتی وقتی مقادیر کم اسید یا باز به
آنها اضافه میشود، محفوظ میماند.
تهیه محلول بافر اسیدی
یک محلول بافر را میتوان از یک اسید ضعیف یا یک باز ضعیف و نمکی از الکترولیت ضعیف تهیه کرد. مثلا ، میتوان بافری
از اسید استیک و استات سدیم تهیه کرد. اگر از این دو ماده به غلظت یکسان مثلا 1M داشته باشیم. در نتیجه:
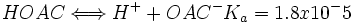
از آنجا که با غلظت HOAC و [SUP]-[/SUP] OAC برابر است، غلظت [SUP]+[/SUP]H برابر با
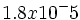
بود. PK یک الکترولیت ضعیف را میتوان به طریقی مشابه با PH تعریف کرد:
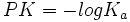
محلولی از یک اسید ضعیف که در آن غلظت آنیون برابر غلظت اسید تفکیک نشده باشد، PH آن برابر PK[SUB]a[/SUB] اسید است.
در نمونه بافری که شرح داده شد، مقادیر HOAC و

اضافه کردن اسید یا باز به محلول بافر
چنانچه مقدار کمی یون
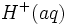
چنانچه به این مقدار بافر مقداری یون
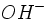
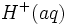
ولی مقدار فروان استیک اسید موجود به وسیله تفکیک مقدار یون
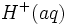
محلول در رقمی نسبتا ثابت محفوظ میماند. بافرها نمیتوانند افزایش مقادیر زیاد اسید یا قلیا را تحمل کنند. افزایش
0.01 مول به ازای یک لیتر از
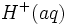
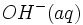
تحمل آن را داشته باشد.
تهیه بافر قلیایی
بافرهای قلیایی را نیز میتوان تهیه کرد. چنانچه باز ضعیف و یون مشتق آن با غلظتهای برابر ، وجود داشته باشند،
داریم:
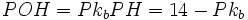
محلولی از

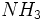
است.
رابطه هندرسون _ باخ
بافرهایی نیز میتوان تهیه کرد که در آنها نسبت غلظت الکترولیت ضعیف به غلظت یون مشترک 1 به 1 نباشد. از این
روش میتوان برای بدست آوردن بافری که PH یا POH آن با


رابطه هندرسون باخ این نوع بافر را توجیه میکند:
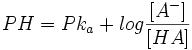
بطور کلی برای یک بافر موثر ، نسبت غلظت جز مولکولی به غلظت جز یونی باید بین 0.1 و 10 باشد. بنابراین برای تهیه
یک بافر موثر میتوان از
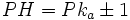
که در آن مقادیر دلخواه PH بین 3.74 و 5.74 را داشته باشد، زیرا مقدار
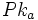
استفاده از محلولهای بافر در صنعت و طبیعت
استفاده از بافرها بخش مهمی از بسیاری فرآیندهای صنعتی است. مثالهایی در این مورد ، آبکاری و تهیه چرم و مواد
عکاسی و رنگها هستند.
در پژوهشهای باکتری شناسی برای حفظ PH لازم جهت رشد باکتریهای مورد مطالعه ، محیطهای کشت معمولا بافری
هستند. بافرها بطور وسیعی در شیمی تجزیه و همچنین برای مدرج کردن PH سنج بکار میرود. بدن انسان به وسیله
بی کربنات ، فسفات و سیستمهای پیچیده پروتئین در

محلول های بافر نمكی
محلول های بافر نمكی، محلول هايی هستند كه با غلظت های مشخص نمكی و PH فيزيولوژيكی ساخته شده كه به
صورت تنها و يا با مخلوطی از ساير معرف ها برای شستشوی بافت ها و سلول ها به كار می روند. اين محلول ها عمدتاً
شامل سديم، پتاسيم، كلسيم، منيزيم و كلرايد هستند كه برای سلولها محيط آبی به همراه يون های غير آلی را فراهم
نموده و در عين حال PH فيزيولوژيك و فشار اسمزی را حفظ می نمايند.
بنابراين نقش اصلی محلول نمكی، حفظ PH فيزيولوژيك و تعادل اسمزی در يك محيط و فراهم نمودن محيط آبی به همراه
يون های غير آلی برای سلول ها بوده كه به عنوان يك فاكتور اصلی از يك قرن پيش تا كنون مورد توجه است.
