انتخاب حلال مناسب+ گزارش آز شيمي آلي1
انتخاب حلال مناسب+ گزارش آز شيمي آلي1
عنوان آزمايش: بررسي و انتخاب حلال مناسب (تبلور)
مقدمه:
تبلور: يكي از مهمترين روشهاي خالص سازي اجسام جامد تبلور ميباشد كه اين عمل بر دو طريق انجام ميشود:
- ذوب كردن كريستالها
- حل كردن در حلال
در هر روش بعد از جدا نمودن ناخالصيها به محلول فرصت تشكيل رسوب و خنك شدن ميدهيم.
شرايط حلال مناسب:
- حلال با جسمي كه ميخواهد خالص نماييد نبايد با هم واكنش داده و محصول جديد تشكيل دهد.
- جسمي كه ميخواهيم خالصسازي كنيم بايد به طور قابل ملاحظهاي در حلال گرم حل شود و در حلال سرد حل نشود.
- حلال نبايد خيلي فرار يا كم فرار باشد كه در حالت دوم مشكل خشك كردن داريم.
- نقطهي ذوب و جوش جسم خالص و حلال بايد تقريبا نزديك به هم باشند.(اختلاف 1-2درجه)
معرفي جامدها در آزمايش
اسيد بنزوئيك
بنزوئیک اسید، (C۷H۶O۲ (C۶H۵COOH، یک ترکیب بلوری بیرنگ (سفید دیده میشود) است. بنزوئیک اسید سادهترین کربوکسیلیک اسید آروماتیک نیز میباشد.
file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image002.jpg
این ماده یک اسید ضعیف محسوب میشود. از نمکهای آن به عنوان نگهدارندههای غذایی استفاده میشود، همچنین در ساخت بسیاری از ترکیبات آلی دیگر از بنزوئیک اسید استفاده میگردد.
بنزوئیک اسید در قرن شانزدهم میلادی کشف شد. اولین بار شخصی به نام Nostradamus از تقطیر خشک مادهای سنتی به نام gum benzoin بدست آورد.
در سال ۱۸۷۵ شخصی به نام Salkowski نیز پی به خواص ضد قارچ بنزوئیک اسید برد.
تنها تولیدکننده اسیدبنزوئیک در ایران، شرکت صنایع شیمیایی و سلولزی نگار آذر بوده که در سه حالت پودر، پرک و مایع محصولات خود را با بهترین کیفیت (خلوص بالای 99/99% طبق گواهی آزمایشگاه مرکزی دانشگاه تهران)به بازار عرضه می نماید.
file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image004.jpg
بنزوئیک اسید و نمکهایش به عنوان نگهدارندهٔ غذا مصرف دارند که به نامهای E212، E211، E210 و E213 شناخته میشوند. هر کدام از این نمکها از واکنش مستقیم یا واکنش با نمکهای سدیم، پتاسیم یا کلسیم تهیه میشوند.
در اصل بنزوئیکاسید از رشد قارچها، مخمرها و بعضی باکتریها جلوگیری میکند. نحوهٔ اثر بنزوئیک اسید اینگونهاست که در ابتدا بنزوئیک اسید جذب سلول میشود، اگر pH درون سلولی به ۵ یا کمتر تغییر کند، تخمیر ناهوازی گلوکز از طریق Phosphofructokinase به میزان ۹۵٪ کاهش مییابد و این خود باعث نابودی آنها میشود. مقدار معمول استفاده از بنزوئیک اسید و نمکهایش به عنوان نگه دارنده بین ٪۰٫۰۵-٪۰٫۱ میباشد. البته در بعضی غذاها باید از سطوح بالاتری از بنزوئیک اسید استفاده شود که مقادیر ماکسیمم آن در قوانین بین المللی غذا موجود است.
البته نگرانیهایی وجود دارد مبنی بر اینکه بنزوئیک اسید با آسکوربیک اسید (ویتامین C) موجود در نوشابهها واکنش داده و مقادیر بسیار کم (ولی در دراز مدت خطرناک) بنزن تولید میشود.
همچنين اسید بنزوئیک جزئی از پماد Whitfield است که برای درمان بیماریهای قارچی پوست و مو استفاده میشود.
از خطرات اسيد بنزوئيك ميتوان به محرک پوست و چشم بودن آن اشاره داشت. بنابراين از تماس اين ماده با چشم و پوست خودداري كنيد.
استانيليد
استانیلید (به انگلیسی: Acetanilide) با فرمول شیمیاییC6H5NHCOCH3 یک ترکیب شیمیایی است. که جرم مولی آن ۱۳۵٫۱۷ g/mol میباشد.
file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image006.gif file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image008.gif
نفتالين
نفتالین که به نامهای «آلبوکربن»، «کافورقیر»، «قیرسفید» یا «نفتالن» نیز گفته میشود؛ یک هیدروکربن آروماتیک است که به نمای گلولههای کوچک به بازار میآیند و حالت جامد و رنگ سفیدی دارد. نفتالین به تندی فرازش(تصعید) مییابد و بخاری بسیار آتشزا دارد. مولکول نفتالین از دو حلقهٔ جوش خوردهٔ بنزن ساخته شده است. كه آن از زغال سنگ به دست میآید و به فتالیک انیدرید برای ساخت پلاستیکها، رنگها و حلکنندهها به کار میرود. نفتالین برای گندزدایی و حشره کشی(بیشتر حل شده در متانول) کاربرد فراوانی دارد. نفتالین را برای جلوگیری از بید زدن فرش و پارچههای پشمی نیز به کار میبرند.
file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image010.gif
تاریخچه
سال ۱۸۱۹ و ۱۸۲۰، دست کم دو شیمیدان مادهٔ جامد سفیدی با بوی زننده گزارش کردند که از تقطیر زغال سنگ به دست میآید. سال ۱۸۲۱، جان کید(John Kidd) بسیاری از ویژگیهای این مادهها و روشهای فرآوری آنها را پیدا کرد و نام نفتالین را برای این ماده پیشنهاد کرد(چون این ماده از گونهای نفتا -که نام گستردهای که برای آمیختهای از هیدروکربنهای فرار و آتشگیر که زغال سنگ را نیز دربرمیگیرند؛ میشود.- به دست آمده بود.) در ادامه فرمول شیمیایی آن توسط مایکل فارادی (Michael Faraday) در سال 1826 کشف شد... ساختار مولکول آن نیز در سال 1866 توسط امیل ارلنمایر (Emil Erlenmeyer) کشف و سه سال بعد توسط کارل گریب (Carl Gräbe) تایید شد.
معرفي حلالها در انجام اين آزمايش:
استون
اَسِتون یک مادهٔ شیمیایی و یکی از لکهبرها است. این ماده فرار و به شدت آتشگیر است و مصرف بسیار زیادی در صنعت به عنوان حلال دارد. یکی از سادهترین روشهای ساخت این ماده تقطیر استات کلسیم است.
file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image012.gif
استون با نامهاي ديگري همچون «دي متيل كتون» و «بتا-كتوپروپان» نيز خوانده ميشود كه فرمول شيميايي آن CH3COCH3 است.
اتانول
اتانول یا الکل اتیلیک یا اتیل الکل یا الکل میوه با فرمول C2H5OH ترکیب شیمیائی با بوی خاص و آتشگیری است که در نوشیدنیهای الکلی وجود دارد. این الکل همان مادهای است که خاصیت مست کنندگی دارد و در نوشیدنیهای الکلی با درصدهای مختلف پیدا میشود. علاوه بر این در صنایع مختلف کاربرد فراوان دارند. این کاربردها در عطرها و ادکلنها و همچنین در وانیل و همچنین به عنوان سوخت در برخی ماشینهای جدید میباشد. برای استفاده از این الکل در صنایع عطر سازی استفاده میکنند.
file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image014.gif
مخمر آبجو، قارچی است که با جوانهزدن تکثیر میشود، اگر این قارچ در مجاور یک ماده قندی تخمیر شود، موادی از خود خارج میکند که خاصیت آنزیمی داشته و موجب دگرگونی قند میشود. در بین قندها، گلوکز به فرمول C6H12O6 است که در انگور وجود دارد که پس از تخمیر باعث ایجاد الکل میشود.
تاریخچه
اتانول برای انسان از دوران باستان شناخته شده بود، زیرا این ماده، جزء اصلی مشروبات الکلی است. جداسازی آن بصورت اتانول نسبتا خالص احتمالا اولین بار توسط "جابر بن حیان" که صنعت تقطیر را گسترش داد، انجام شده است. البته بیشتر گمان میرود که اتانول خالص توسط "محمد زکریای رازی" دانشمند ایرانی تولید شده باشد.
اتانول به دلیل نقطه ذوب پائین در صنعت ضدیخسازی استفاده میشود. حلال بسیار خوبی است و در صنعت عطرسازی، رنگسازی و … استفاده میشود. محلول ٪۸۵ – ۷۰ آن بعنوان محلول ضدعفونیکننده کاربرد دارد. اتانول با تغییر دادن پروتئین و حل کردن چربی، میکروارگانیسمهای آنها را از بین میبرد. البته این عمل فقط در برابر باکتریها و ویروسها و قارچها موثر است، ولی در مقابل هاگ باکتریها تاثیری ندارد. اتانول همچنین در صنایع مشروبات الکلی به میزان گسترده ای مورد استفاده قرار میگیرد.
file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image016.jpg
فواید استفاده از الکل در حد عادی (رنگ سبز در سمت راست تصوير و همچنين زير تصوير) و مضرات استفاده بیش از حد (رنگ قرمز در سمت چپ تصوير)
مصرف بیش از حد مشروبات الکلی، به دلیل وجود اتانول در ترکیب آنها باعث ایجاد عوارض بسیاری در سلامتی انسان میشود که عبارتند از :
عوارض حاد: تهوع، استفراغ، افسردگی، تنگی نفس.
عوارض مزمن: اعتیاد به الکل (الکسیم)، سایروز کبدی، تاثیر در سلسله اعصاب مرکزی، تاثیر در حافظه در بلند مدت.
آب
file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image018.jpg
آب مایه حیات و فراوانترین مادهٔ مرکب بر روی سطح کره زمین و بستر اولیه حیات به شکلی که امروزه میشناسیم. بیش از ۷۵٪ جرم یک انسان از آب تشکیل شدهاست و نیز بیش از ۷۰٪ سطح کره زمین را آب پوشانده است (نزدیک به ۳۶۰ میلیون از ۵۱۰ میلیون کیلومتر مربع) با وجود این حجم عظیم آب تنها 2 درصد از آبهای کره زمین شیرین و قابل شرب است و باقی آن به علت محلول بودن انواع نمکها خصوصاً نمک طعام غیر قابل استفاده است. از همین 2٪ آب شیرین بیش از 90% به صورت منجمد در دو قطب زمین و دور از دسترس بشر واقع شدهاست. فرمول شيميايي آب H2O بوده و شكل فضايي آن به صورتي است كه در تصوير زير مشاهده ميكنيد.
file:///C:\DOCUME~1\ALI~1.DEL\LOCALS~1\Temp\msohtml1\01\clip_image020.gif
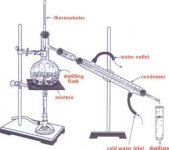
وسايل آزمايش:
- سه ماده: استانيليد- اسيد بنزوئيك- نفتالين
- سه حلال: استون – اتانول- آب مقطر
- همزن
- چراغ بنزن
- كبريت
- سه عدد اسپاتول
- گيره
- لولهي آزمايش
شرح آزمايش و دستور كار:
به اندازهي نوك اسپاتول از مادهي اوليه مجهول(استانيليد، اسيد بنزوئيك يا نفتالين) داخل لولهي آزمايش تميز و خشكي ميريزيم، به اندازهي يك بند انگشت (3تا4ميليليتر) حلال ( استون، اتانول يا آب مقطر) به آن اضافه ميكنيم و اثر حلال و ماده را گزارش ميكنيم.
ابتدا استانيليد را برداشته و اثر تمامي حلالها را روي آن بررسي كرده و سپس به سراغ مادهي ديگر ميرويم.
استانيليد+استون: استانيليد به سرعت در استون حل شد.
به علت حل شدن استانيليد در استون سرد (قبل از گرما دادن) استون حلال مناسبي براي استانيليد نيست؛ زيرا يكي از خواص حلال مناسب بودن آن بود كه در حلال سرد حل نشده و با كمي گرما حل شود. بنابراين محلول را خالي كرده و باز به اندازهي نوك اسپاتول استانيليد داخل لولهي آزمايش ريخته و اين بار به آن به اندازهي يك بند انگشت اتانول اضافه ميكنيم.
استانيليد + اتانول: استانيليد به سرعت در اتانول حل شد.
به علت ذكر شده در بالا، اتانول نيز حلال مناسبي نيست، پس آزمايش را بار ديگر با آب مقطر تكرار ميكنيم.
استانيليد + آب مقطر: حل نشده
بنابراين، محلول را روش چراغ بنزن با شعلهي كم و آبي گرم ميكنيم، مشاهده ميشود كه استانيليد درون آب مقطر حل شد، حال محلول را سرد ميكنيم تا رسوب ظاهر شود، ظاهر شدن رسوب تاييد خوب بودن حلال است.
نفتالين در آب سرد حل نميشود و هنگامي كه آب را گرم ميكنيم مشاهده ميشود كه همچنان نفتالين حل نشده و به صورت دو فاز مجزا و ژلهاي مانند حاصل ميشود.
علت اين امر تفاوت در نقطهي ذوب و جوش بين آب و نفتالين است.
همانطور كه ميدانيم نقطهي جوش آب 100 درجه اما نقطهي جوش نفتالين 50درجه ميباشد.
حال از بين سه حلال، مناسبترين آن را انتخاب و گزارش ميكنيم.
استانيليد + استون ← سريع حل ميشود← حلال مناسبي نيست
استانيليد + اتانول ← سريع حل ميشود← حلال مناسبي نيست
استانيليد +آب مقطر ← هنگامي كه سرد باشد حل نميشود پس آن را گرم ميكنيم.
استانيليد + آب مقطر گرم ← حل ميشود← رسوب نيز تشكيل ميشود← حلال مناسبي است.
اسيد بنزوئيك + استون ← سريع حل ميشود← حلال مناسبي نيست
اسيد بنزوئيك + اتانول ← سريع حل ميشود← حلال مناسبي نيست
اسيد بنزوئيك +آب مقطر ← هنگامي كه سرد باشد حل نميشود پس آن را گرم ميكنيم.
اسيد بنزوئيك + آب مقطر گرم ← حل ميشود← رسوب نيز تشكيل ميشود← حلال مناسبي است.
نفتالين+ استون ← سريع حل ميشود← حلال مناسبي نيست
نفتالين + اتانول ← هنگامي كه سرد باشد حل نميشود پس آن را گرم ميكنيم
نفتالين + اتانول گرم ← حل شده← رسوب تشكيل ميشود← حلال خوبي است
نفتالين +آب مقطر ← هنگامي كه سرد باشد حل نميشود پس آن را گرم ميكنيم.
نفتالين + آب مقطر گرم ← حل نميشود← 2فاز (ژلهاي مانند شدن نفتالين)← حلال مناسبي نيست.
نتيجه:
حلال مناسب براي استانيليد آب بوده و براي اسيد بنزوئيك نيز آب است اما براي نفتالين به علت تفاوت فاحش در نقطهي جوش آب حلال مناسب نبوده و اتانول حلال مناسب آن است.
استون اساسا حلال مناسبي نيست
 [FONT="][/FONT]
[FONT="][/FONT]