*مینا*
کاربر فعال شیمی
کاتالیزور ماده ای است که سرعت یک واکنش شیمیایی را افزایش می دهد بدون آنکه خود در جریان واکنش مصرف شود.
ریشه لغوی
کاتالیزور از دو صفت کاتا و لیزور تشکیل شده است. در زبان یونانی "کاتا" به معنای پائین ، افتادن ، یا پائین افتادن است و "لیزور" به معنی قطعه قطعه کردن میباشد. در برخی زبانها کاتالیزور را به معنی گردهم آوردن اجسام دور از هم معرفی کرده اند.
تاریخچه
اولین گزارش استفاده از کاتالیزور ، مربوط به کریشف میباشد که با استفاده از یک اسید به عنوان کاتالیزور توانست نشاسته را به قند ، هیدرولیزکند. بعدها دیوی توانست واکنش اکسیداسیون هیدروژن را با اکسیژن در حضور کاتالیزورپلاتین انجام دهد که این واکنش یک واکنش گرما گیر است و در نتیجه هنگام انجام واکنش جرقه تولید میشد.
اولین کار در توضیح اینکه چرا یک واکنش کاتالیزوری انجام میگیرد و کاتالیزور چه نقشی دارد، توسط "فارادی" انجام شد. بیشترین بهرهبرداری از کاتالیزور در جنگ جهانی بود.
انقلاب تکنولوژی اصلی در زمینه کاتالیزور مربوط به نیمه دوم قرن 20 یعنی بین سالهای1980 ـ 1950 میباشد.دهه 1960 ـ 1950 دهه ای است که با تولید کاتالیزورهای زیگر _ ناتا ترکیبات بسیار مهم و استراتژیک ساخته شد.
انواع کاتالیزور
کاتالیزور به دو نوع کاتالیزور مرغوب و نامرغوب تقسیم میشود:
چگونگی عمل کاتالیزور
تجربه نشان داده است که واکنش با کاتالیزور در دمای کمتری صورت میگیرد و همچنین کاتالیزور ، انرژی اکتیواسیون را پائین میآورد یا کاهش میدهد یا باعث میشود مولکولهای درشت به مولکولهای کوچکتر ، قطعهقطعه یا شکسته شوند.
کاتالیزور واکنش را میتوان بدون تغییر در پایان واکنش بدست آورد. مثلا سرعت تجزیه KClO3 را با مقدار کمی MNO2 میتوان فوقالعاده زیاد کرد. در معادلهای که برای این تغییر نوشته میشود ، کاتالیزور را بالای پیکان میگذارند ، زیرا کاربرد آن در استوکیومتری کل واکنش اثری ندارد:
کاتالیزور نمیتواند موجب وقوع واکنشهایی شود که از نظر ترمودینامیک امکان وقوع ندارند. بعلاوه صرفا حضور کاتالیزور نیست که (احتمالا بعنوان یک بخش فعالکننده) موجب اثر بر سرعت واکنش میشود. در یک واکنش کاتالیزوردار ، کاتالیزور در یک مرحله عملا مصرف میشود و در مرحله بعدی بار دیگر تولید میگردد و این عمل بارها تکرار میگردد، بدون آنکه کاتالیزور دچار تغییر دائمی شود.
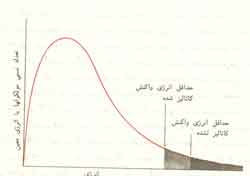
بنابراین کار کاتالیزور آن است که راه تازه ای برای پیشرفت واکنش میگشاید. بدین ترتیب مکانیسم کاتالیزوردار با یک واکنش بیکاتالیزور تفاوت دارد. انرژی فعال سازی راهی که واکنش به کمک کاتالیزور طی میکند، کمتر از انرژی فعالسازی راهی است که همان واکنش بدون کاتالیزور میپیماید (شکل 1)
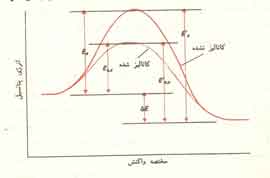
این واقعیتی است که علت سریعتر شدن واکنش را توجیه میکند. وقتی کاتالیزور بکار برده میشود، مولکولهای نسبتا بیشتری انرژی لازم برای یک برخورد موفق پیدا میکنند (شکل 2). بدین ترتیب عده کل برخوردهای موثر در واحد زمان، که موجب انجام واکنش میشوند، افزایش مییابد.
در شکل 1 به دو نکته دیگر نیز پی میبریم. نخست آنکه تغییرات انرژی برای واکنش کاتالیزوردار و واکنش بیکاتالیزور یکسان است. دیگر آنکه انرژی فعال سازی واکنش معکوس نیز به هنگام استفاده از کاتالیزور کاهش مییابد و مقدار کاهش آن درست برابر کم شدن انرژی فعال سازی واکنش کاتالیزوردار اصلی است. این بدان معنی است که کاتالیزور بر یک واکنشی و واکنش معکوس آن اثر یکسان دارد. اگر یک کاتالیزور سرعت یک واکنش را دو برابر کند، همان کاتالیزور سرعت واکنش معکوس آن را نیز دو برابر خواهد کرد.
کاتالیزورهای طبیعی (آنزیم)
بسیاری از فرایندهای صنعتی به اعمالی بستگی دارند که با کاتالیزور صورت میگیرند. ولی کاتالیزورهایی که برای انسان مورد اهمیت بیشتری دارند، کاتالیزورهای طبیعی یعنی آنزیمها هستند. این مواد فوق العاده پیچیده ، فرایندهای حیاتی مانند گوارش و سنتز سلولی را کاتالیز میکنند.
عده زیادی از واکنشهای شیمیایی پیچیده که در بدن صورت میگیرد و برای حیات ما ضرورت دارد، به علت اثر آنزیمها در دمای پائین بدن امکان وقوع پیدا میکنند. هزاران آنزیم وجود دارند که هر یک وظیفه خاصی را انجام میدهند. تحقیق درباره ساختمان و عمل آنزیمها ، نویدهای فراوانی درباره پیشرفت شناخت عامل بیماری و مکانیسم رشد میدهد.
کاتالیزور همگن و ناهمگن
در کاتالیزور همگنماده ای که بعنوان کاتالیزور کار میکند، با مواد واکنشدهنده در یک فازند، ولی در یک کاتالیزور ناهمگن یا کاتالیزور سطحی ، مواد واکنشدهنده و کاتالیزور در دو فاز مجزا کنار هم هستند و واکنش در سطح کاتالیزور صورت میگیرد.
کاتالیزور همگن
نمونه ای از کاتالیزور همگن در فاز گازی ، اثر کلر در تجزیه دینیترون اکسید است. گاز دینیترون اکسید ، در دمای اتاق ، گاز نسبتا بیاثری است، اما در دماهای نزدیک به صد درجه طبق معادله زیر تجزیه می شود.
مطالعات سینتیک نشان میدهد که واکنش مذکور بر اثر برخورد بین دو ملکول کلر کاتالیز میشود.
کاتالیزور همگن در محلول نیز ممکن است صورت گیرد. بسیاری از واکنشها بوسیله اسیدها و بازها کاتالیز میشوند. تجزیه هیدروژن پراکسید در حضور پون یدید کاتالیز میشود.
کاتالیزور ناهمگن
کاتالیزور ناهمگن عمدتا از طریق جذب سطحی شیمیایی مواد واکنش دهنده بر سطح کاتالیزور صورت میگیرد. جذب سطحی فرآیندی است که در جریان آن مولکولها به سطح جسمی جامد میچسبند. مثلا در ماسکهای گازی ، زغال به عنوان یک ماده جاذب برای گازهای زیان آور بکار میرود.
در جذب سطحی فیزیکی معمولی ، مولکولها ، بوسیله نیروهای و اندروالسی به سطح ماده جاذب ، گیر میکنند. بنابراین مولکولهایی از گاز که جذب سطحی شدهاند، تا همان حد تحت تاثیر قرار گرفتهاند که گویی مایع شده باشند.
در جذب سطحی شیمیایی ، مولکولهای جذب شده ، با پیوندهایی که قابل مقایسه با پیوندهای شیمیایی است، به سطح ماده کاتالیزور نگه داشته میشوند. در فرایند تشکیل پیوند با ماده جاذب ، مولکولهایی که بطور شیمیایی جذب شدهاند، دچار تغییر آرایش الکترونی درونی میشوند. پیوندهای درون بعضی از مولکولهای کشیده و ضعیف و حتی پیوند بعضی از آنها شکسته میشوند.
مثلا هیدروژن بصورت اتمی بر سطح پلاتین جذب میشود. بنابراین تعدادی از ملکولها که بطور شیمیایی جذب سطحی شدهاند، به صورت کمپلکس فعال شده یک واکنشی که در سطح کاتالیزور شده، عمل میکند.
مکانیسم جذب سطحی شیمیایی:
تاکنون مکانیسم دقیق جذب سطحی شیمیایی و کاتالیز سطح کاملا فهمیده نشده است، فقط فرضهایی قابل قبول برای مکانیسم چند واکنش خاصی مطرح شده است:
اگر کاتالیزورآهن با مقدار کمی پتاسیم یا وانادیم آمیخته شده باشد، بیشتر موثر واقع میشود
ریشه لغوی
کاتالیزور از دو صفت کاتا و لیزور تشکیل شده است. در زبان یونانی "کاتا" به معنای پائین ، افتادن ، یا پائین افتادن است و "لیزور" به معنی قطعه قطعه کردن میباشد. در برخی زبانها کاتالیزور را به معنی گردهم آوردن اجسام دور از هم معرفی کرده اند.
تاریخچه
اولین گزارش استفاده از کاتالیزور ، مربوط به کریشف میباشد که با استفاده از یک اسید به عنوان کاتالیزور توانست نشاسته را به قند ، هیدرولیزکند. بعدها دیوی توانست واکنش اکسیداسیون هیدروژن را با اکسیژن در حضور کاتالیزورپلاتین انجام دهد که این واکنش یک واکنش گرما گیر است و در نتیجه هنگام انجام واکنش جرقه تولید میشد.
اولین کار در توضیح اینکه چرا یک واکنش کاتالیزوری انجام میگیرد و کاتالیزور چه نقشی دارد، توسط "فارادی" انجام شد. بیشترین بهرهبرداری از کاتالیزور در جنگ جهانی بود.
انقلاب تکنولوژی اصلی در زمینه کاتالیزور مربوط به نیمه دوم قرن 20 یعنی بین سالهای1980 ـ 1950 میباشد.دهه 1960 ـ 1950 دهه ای است که با تولید کاتالیزورهای زیگر _ ناتا ترکیبات بسیار مهم و استراتژیک ساخته شد.
انواع کاتالیزور
کاتالیزور به دو نوع کاتالیزور مرغوب و نامرغوب تقسیم میشود:
- کاتالیزور مرغوب: کاتالیزور مرغوب به کاتالیزوری گفته میشود که فقط اجازه تشکیل یک نوع محصول را بدهد.
- کاتالیزور نامرغوب: اگر در حضور کاتالیزور محصولات متفاوتی امکان تشکیل داشته باشند کاتالیزور نامرغوب تلقی میشود.
چگونگی عمل کاتالیزور
تجربه نشان داده است که واکنش با کاتالیزور در دمای کمتری صورت میگیرد و همچنین کاتالیزور ، انرژی اکتیواسیون را پائین میآورد یا کاهش میدهد یا باعث میشود مولکولهای درشت به مولکولهای کوچکتر ، قطعهقطعه یا شکسته شوند.
کاتالیزور واکنش را میتوان بدون تغییر در پایان واکنش بدست آورد. مثلا سرعت تجزیه KClO3 را با مقدار کمی MNO2 میتوان فوقالعاده زیاد کرد. در معادلهای که برای این تغییر نوشته میشود ، کاتالیزور را بالای پیکان میگذارند ، زیرا کاربرد آن در استوکیومتری کل واکنش اثری ندارد:
KClO3--------->2KCl+3O2
مکانیسم واکنش کاتالیزوردار
مکانیسم واکنش کاتالیزوردار
کاتالیزور نمیتواند موجب وقوع واکنشهایی شود که از نظر ترمودینامیک امکان وقوع ندارند. بعلاوه صرفا حضور کاتالیزور نیست که (احتمالا بعنوان یک بخش فعالکننده) موجب اثر بر سرعت واکنش میشود. در یک واکنش کاتالیزوردار ، کاتالیزور در یک مرحله عملا مصرف میشود و در مرحله بعدی بار دیگر تولید میگردد و این عمل بارها تکرار میگردد، بدون آنکه کاتالیزور دچار تغییر دائمی شود.
بنابراین کار کاتالیزور آن است که راه تازه ای برای پیشرفت واکنش میگشاید. بدین ترتیب مکانیسم کاتالیزوردار با یک واکنش بیکاتالیزور تفاوت دارد. انرژی فعال سازی راهی که واکنش به کمک کاتالیزور طی میکند، کمتر از انرژی فعالسازی راهی است که همان واکنش بدون کاتالیزور میپیماید (شکل 1)

این واقعیتی است که علت سریعتر شدن واکنش را توجیه میکند. وقتی کاتالیزور بکار برده میشود، مولکولهای نسبتا بیشتری انرژی لازم برای یک برخورد موفق پیدا میکنند (شکل 2). بدین ترتیب عده کل برخوردهای موثر در واحد زمان، که موجب انجام واکنش میشوند، افزایش مییابد.
در شکل 1 به دو نکته دیگر نیز پی میبریم. نخست آنکه تغییرات انرژی برای واکنش کاتالیزوردار و واکنش بیکاتالیزور یکسان است. دیگر آنکه انرژی فعال سازی واکنش معکوس نیز به هنگام استفاده از کاتالیزور کاهش مییابد و مقدار کاهش آن درست برابر کم شدن انرژی فعال سازی واکنش کاتالیزوردار اصلی است. این بدان معنی است که کاتالیزور بر یک واکنشی و واکنش معکوس آن اثر یکسان دارد. اگر یک کاتالیزور سرعت یک واکنش را دو برابر کند، همان کاتالیزور سرعت واکنش معکوس آن را نیز دو برابر خواهد کرد.
کاتالیزورهای طبیعی (آنزیم)
بسیاری از فرایندهای صنعتی به اعمالی بستگی دارند که با کاتالیزور صورت میگیرند. ولی کاتالیزورهایی که برای انسان مورد اهمیت بیشتری دارند، کاتالیزورهای طبیعی یعنی آنزیمها هستند. این مواد فوق العاده پیچیده ، فرایندهای حیاتی مانند گوارش و سنتز سلولی را کاتالیز میکنند.
عده زیادی از واکنشهای شیمیایی پیچیده که در بدن صورت میگیرد و برای حیات ما ضرورت دارد، به علت اثر آنزیمها در دمای پائین بدن امکان وقوع پیدا میکنند. هزاران آنزیم وجود دارند که هر یک وظیفه خاصی را انجام میدهند. تحقیق درباره ساختمان و عمل آنزیمها ، نویدهای فراوانی درباره پیشرفت شناخت عامل بیماری و مکانیسم رشد میدهد.

کاتالیزور همگن و ناهمگن
در کاتالیزور همگنماده ای که بعنوان کاتالیزور کار میکند، با مواد واکنشدهنده در یک فازند، ولی در یک کاتالیزور ناهمگن یا کاتالیزور سطحی ، مواد واکنشدهنده و کاتالیزور در دو فاز مجزا کنار هم هستند و واکنش در سطح کاتالیزور صورت میگیرد.
کاتالیزور همگن
نمونه ای از کاتالیزور همگن در فاز گازی ، اثر کلر در تجزیه دینیترون اکسید است. گاز دینیترون اکسید ، در دمای اتاق ، گاز نسبتا بیاثری است، اما در دماهای نزدیک به صد درجه طبق معادله زیر تجزیه می شود.
(2N2O(g)--------->2N2(g)+O2(g
مطالعات سینتیک نشان میدهد که واکنش مذکور بر اثر برخورد بین دو ملکول کلر کاتالیز میشود.
کاتالیزور همگن در محلول نیز ممکن است صورت گیرد. بسیاری از واکنشها بوسیله اسیدها و بازها کاتالیز میشوند. تجزیه هیدروژن پراکسید در حضور پون یدید کاتالیز میشود.
کاتالیزور ناهمگن
کاتالیزور ناهمگن عمدتا از طریق جذب سطحی شیمیایی مواد واکنش دهنده بر سطح کاتالیزور صورت میگیرد. جذب سطحی فرآیندی است که در جریان آن مولکولها به سطح جسمی جامد میچسبند. مثلا در ماسکهای گازی ، زغال به عنوان یک ماده جاذب برای گازهای زیان آور بکار میرود.
در جذب سطحی فیزیکی معمولی ، مولکولها ، بوسیله نیروهای و اندروالسی به سطح ماده جاذب ، گیر میکنند. بنابراین مولکولهایی از گاز که جذب سطحی شدهاند، تا همان حد تحت تاثیر قرار گرفتهاند که گویی مایع شده باشند.
در جذب سطحی شیمیایی ، مولکولهای جذب شده ، با پیوندهایی که قابل مقایسه با پیوندهای شیمیایی است، به سطح ماده کاتالیزور نگه داشته میشوند. در فرایند تشکیل پیوند با ماده جاذب ، مولکولهایی که بطور شیمیایی جذب شدهاند، دچار تغییر آرایش الکترونی درونی میشوند. پیوندهای درون بعضی از مولکولهای کشیده و ضعیف و حتی پیوند بعضی از آنها شکسته میشوند.
مثلا هیدروژن بصورت اتمی بر سطح پلاتین جذب میشود. بنابراین تعدادی از ملکولها که بطور شیمیایی جذب سطحی شدهاند، به صورت کمپلکس فعال شده یک واکنشی که در سطح کاتالیزور شده، عمل میکند.
مکانیسم جذب سطحی شیمیایی:
تاکنون مکانیسم دقیق جذب سطحی شیمیایی و کاتالیز سطح کاملا فهمیده نشده است، فقط فرضهایی قابل قبول برای مکانیسم چند واکنش خاصی مطرح شده است:
- نظری دال بر اینکه نقصها یا بینظمیهای شبکه در سطح کاتالیزور ، جای فعالی برای عمل کاتالیزور است، اولین فرضیه برای توضیح عمل تقویت کنندههای کاتالیزورهای مناسب است. تقویت کننده ها موادی هستند که فعالیت کاتالیزور ها را زیاد میکنند. مثلا در سنتز آمونیاک
(N2(g)+3H2(g)----------->2NH3(g
اگر کاتالیزورآهن با مقدار کمی پتاسیم یا وانادیم آمیخته شده باشد، بیشتر موثر واقع میشود
آخرین ویرایش توسط مدیر:
