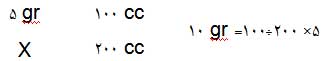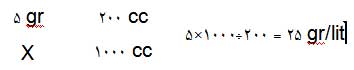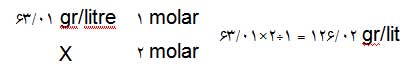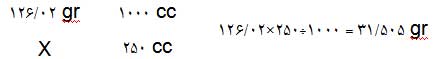محلول سازی
محلول سازی یکی از ابتدایی ترین کارهای در ازمایشگاه است که لازمه هر کار ازمایشگاهی است به همین جهت در این جا روش های ساده ومختصری در مورد محلول سازی در ازمایشگاه برای شما جمع اوری کرده ام و امیدوارم که مورد استفاده قرار گیرد.
محلول سازی از محلول های غلیظ ازمایشگاه
معمولا در ازمایشگاه محلول ها به صورت غلیظ و با درصد خلوص مشخص و استانداردی وجود دارد و برای تهیه محلول های رقیق تر باید از ان ها استفاده کرد.
برای این کار از روابط رقیق سازی استفاده می کنیم :
http://toska256.persiangig.com/image 01/01.jpg
در رابطه بالا نیاز است که نرمالیته یا مولاریته محلول غلیظ موجود در ازمایشگاه را تعیین کنیم. برای تعیین نرمالیته از فرمول زیر استفاده می کنیم :
http://toska256.persiangig.com/image 01/02.jpg
نرمالیته محلول غلیظ را بدست اوردیم. در رابطه اول فقط حجم محلول غلیظ ( v2 ) مجهول است که محاسبه می شود و فقط کافی است این مقدار (v1)را از محلول غلیظ برداشته و به حجم مورد نظر ( v2 ) برسانیم.
برای تعیین نرمالیته و مولاریته محلول های ازمایشگاهی می توانید از جدول زیر استفاده کنید. که در این صورت فقط به رابطه اول نیاز خواهید داشت.
http://toska256.persiangig.com/image 01/03.jpg
مثال :
100cc محلول اسید سولفوریک 2N تهیه کنید ؟
اطلاعاتی نظیر دانسیته , درصد خلوص , جرم مولکولی و ... را می توانید از برچسب روی ظرف محلول بدست اورید.
http://toska256.persiangig.com/image 01/05.jpg
مقدار 5.43cc از محلول غلیظ اسید سولفوریک برداشته و به حجم 100cc برسانید. ( در بالون ژوژه 100cc )
تذکر : در مورد اسید های غلیظ و قوی مثل اسید سولفوریک همیشه اسید را به اب اضافه می کنیم. ( قبل از اضافه کردن اسید مقداری اب مقطر در بالون بریزید و سپس اسید را اضافه کنید. )
____________________________________________________________
____________________________________________________________
برای تهیه محلول های ازمایشگاهی می توانید از نرم افزار محلول سازی استفاده کنید. (فایل پیوست)
پیوست ها
آخرین ویرایش توسط مدیر: