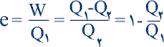قانون دوم ترموديناميك متضمن اين مفهوم است كه يك فرايند فقط در يك جهت معين پيش مي رود
و در جهت خلاف آن قابل وقوع نيست. اين محدوديت براي جهت وقوع يك فرايند, مختصه قانون دوم
است.اگرسيكلي متناقض با قانون اول ترموديناميك نباشد, دليلي براين نيست كه آن سيكل حتماً
اتفاق مي افتد. همين امر منجر به تنظيم قانون دوم ترموديناميك شده است. دو بيان كلاسيك از
قانون دوم ترموديناميك وجود دارد كه هر دو بيانگر يك مفهوم اساسي هستند: بيان كلوين- پلانك
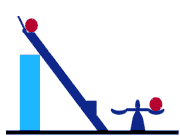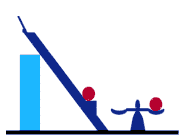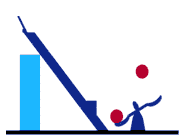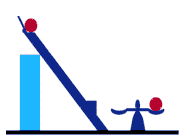
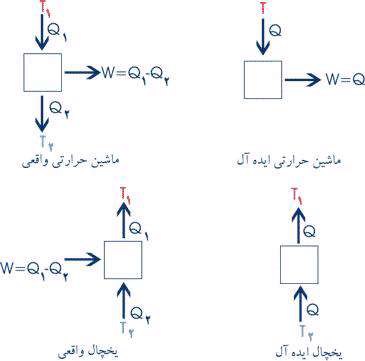
و بيان كلازيوس , بيان كلوين- پلانك بر پايه توضيح عملكرد موتورهاي حرارتي است وبيان مي دارد
كه غيرممكن است وسيله اي بسازيم كه در يك سيكل عمل كند و در عين حال كه با يك مخزن
تبادل حرارت دارد اثري بجز صعود وزنه داشته باشد. اين بيان از قانون دوم ترموديناميك در بر گيرنده
اين مضمون است كه غير ممكن است كه يك موتور حرارتي مقدار مشخصي حرارت را از جسم
درجه حرارت بالا دريافت كند و همان مقدار نيز كار انجام دهد.
بيان كلازيوس نيز يك بيان منفي است و اعلام مي دارد كه غير ممكن است وسيله اي بسازيم
كه در يك سيكل عمل كند و تنها اثر آن انتقال حرارت از جسم سردتر به جسم گرمتر باشد. اين
بيان بر پايه توضيح عملكرد پمپهاي حرارتي مي باشد و دربرگيرنده اين مفهوم است كه نمي توان
يخچالي ساخت كه بدون كار ورودي عمل كند. هر دو بيان كلاسيك از قانون دوم ترموديناميك نوعاً
بيانهاي منفي هستند و اثبات بيان منفي ناممكن است. درباره قانون دوم ترموديناميك گفته ميشود
"هر آزمايش مربوطي كه صورت گرفته به طور مستقيم يا غيرمستقيم ﻤﺆيد قانون دوم بوده و هيچ
آزمايشي منجر به نقض قانون دوم نشده است. همانگونه كه ذكر شد تنها گواه ما بر صحت قانون
دوم ترموديناميك آزمايشات گوناگوني است كه همگي درستي اين قانون را ﺘﺄييد مي كنند.
با اين همه در ترموديناميك كلاسيك سعي مي كنند نشان دهند كه اثبات معادل بودن دو بيان
كلوين- پلانك و كلازيوس دليلي بر صحت قانون دوم ترموديناميك است. در حاليكه اين امر درستي
قانون دوم را اثبات نمي كند. در اثبات اينكه دو بيان فوق الذكر معادل يكديگرند از يك مدل منطقي
بهره جسته مي شود كه مي گويد: " دو بيان, معادل هستند اگر صحت هر بيان منجر به صحت
بيان ديگر گردد و اگر نقض هر بيان باعث نقض بيان ديگر شود."
در ترموديناميك كلاسيك ,معادل بودن دو بيان كلوين- پلانك و كلازيوس با اين آزمايش ذهني استنتاج
مي شود. در شكل نشان داده مي شود كه نقض بيان كلازيوس منجر به نقض بيان كلوين- پلانك
مي شود. وسيله سمت چپ ناقض بيان كلازيوس است. زيرا كه يك پمپ حرارتي است كه نيازي
به كار ندارد. وسيله سمت راست يك موتور حرارتي است. در اينجا به دليل اينكه انتقال حرارت
خالص با منبع درجه حرارت پايين وجود ندارد پس پمپ حرارتي و موتور حرارتي و منبع درجه حرارت
بالا مشتمل بر يك سيكل ترموديناميكي است اما فقط با يك مخزن تبادل حرارت دارد بنابراين
نتيجه مي شود كه ناقض بيان كلوين- پلانك مي باشد. و گفته مي شود تساوي كامل اين دو بيان
هنگامي اثبات مي شود كه نقض بيان كلوين- پلانك نيز موجب نقض بيان كلازيوس بشود. با اين
وصف بايد بپذيريم كه دو بيان فوق, منتج از يكديگر هستند. " در اثبات معادل بودن چند گزاره اگر
عبارتي بصورت B ↔A بيان شده باشد آنگاه B نتيجه A است و A هم نتيجه B , بعبارت ديگر AوB
معادل يكديگر هستند, بالعكس اگر A وB معادل يكديگر باشند, هريك از آنها نتيجه ديگري است.
معادل بودن دو بيان كلوين- پلانك و كلازيوس را مي توان با استفاده از قانون لايب نيتس نشان داد
كه مي گويد: اگر Aو B يكسان و همانند باشند بايد تمام ويژگيها و خاصه هاي آنها نيز يكسان
باشد. از اصل لايب نيتس گاهي به عنوانidentical_ indescernibility of_ يا اصل نامتمايز بودن
همانها ياد مي شود. در واقع اين اصل منطقي بيان مي دارد كه " اگر يك ويژگي يافت شود كه A
آن را داراست اما B فاقد آن است بنابراين A وB موجوديتهاي مجزايي خواهند بود.
دو بيان كلازيوس و كلوين- پلانك معادل يكديگرند زيرا كه هر دو متضمن اين ويژگي هستند كه ساخت
يك ماشين حركت دائمي Perpetual movement machine)) ممكن نميباشد. روشهاي اثبات
منطقي در بسياري از قضاياي ترموديناميك بر پايهء آزمايشهاي ذهني مي باشد. نظير اثبات قضاياي
كارايي سيكل كارنو كه در آن نخست فرضي را مطرح كرده و سپس نشان داده مي شود كه آن
فرض به نتايج غيرممكن مي انجامد و چون روش استدلال در اين آزمايش ذهني نوعاً درست بوده
تنها حالت ممكن اين است كه فرض اوليه نادرست باشد.
نامساوي كلازيوس و قانون دوم ترموديناميك
اغلب گفته مي شود كه نامساوي كلازيوس لازمه قانون دوم ترموديناميك است. نامساوي كلازيوس
را با بررسي سيكل موتور حرارتي و يخچال اثبات مي كنند. اما با التفات به اثبات نامساوي كلازيوس
بايد بپرسيم كه چگونه نامساوي كلازيوس لازمه قانون دوم است در حاليكه طي مراحل آن از قانون
دوم مستثني نيست و در روند اثبات آن مدام به قانون دوم استناد مي شود؟
در اينجا نامساوي كلازيوس ,صحت خود را از درستي ازپيش معلوم فرض شدهء قانون دوم وام مي
گيرد "هر دليلي كه در دفاع از فرضيه اي اقامه مي كنيم بايد غير از نتيجه و مستقل از آن باشد. اگر
تنها گواه صدق ما خود نتيجه باشد استنتاج مشتمل بر دور و لذا كاملاً نارضايت بخش خواهد بود."
گواه صدق نامساوي كلازيوس نيز قانون دوم است بنابراين نامساوي كلازيوس نمي تواند لازمه قانون
دوم ترموديناميك باشد.
نتايج فلسفي قانون دوم ترموديناميك
همانطور كه قانون اول ترموديناميك منجر به تنظيم خاصيتي به نام انرژي شد قانون دوم ترموديناميك
به ابداع مفهوم مجردي به نام آنتروپي (Entropy) مي انجامد. اين قانون ازاهميت فلسفي فوق العاده
اي برخورداراست و هميشه نظريات و مباحثات گوناگوني پيرامون آن در گرفته است.
قانون دوم ترموديناميك را عده اي به عنوان دليلي بر وجود خدا بسيار با ارزش تلقي كرده اند(خدايي
كه جهان را در حالت كمترين آنتروپي آفريد و از آن پس جهان مدام از اين حالت دورتر مي شود و رو
به تباهي مي رود).اما برعكس عده اي هم آنرا به دليل ناسازگاري با ماترياليسم ديالكتيك ونفي
كمال پذيري وضعيت انسان مردود دانسته اند.آنتروپي معياري براي بي نظمي يك سيستم است.
هرقدر نظم ساختاري و عملكردي يك سيستم كمتر باشد گفته مي شود آنتروپي آن بيشتر است.
طبق قانون دوم ترموديناميك هر فعاليت طبيعي موجب افزايش آنتروپي مي شود و جهت و گرايش
طبيعت نيز به سوي بي نظمي است. "اوراق منظمي كه پشت سر هم چيده شده اند يا كتابهايي
كه بطور مرتب در قفسهء كتابخانه قرار دارند ,اگر كوششي در جهت برقراري نظم آنها انجام نگيرد و
مثلاً اهميتي داده نشود تا هر كتاب برداشته شده باز به جاي اوليه اش برگردانده شود بي نظمي
يا به عبارتي آنتروپي آن روز به روز بيشتر خواهد شد. شايد به نظر برسد كه در طبيعت فرايندهايي
هم هست كه در آنها از يك حالت بي نظم به يك حالت منظم برسيم. مثلا فرايند ساختن ساختمان
عبارتست از نظم دادن به مقداري آجر خاك سيمان و آهن پراكنده و بي نظم واينطور برداشت شود
كه چنين فرايندهايي در جهت افزايش نظم و به تبع آن كاهش آنتروپي پيش مي رود. اما بايد گفت
كه قانون دوم ترموديناميك يك سيستم را مجزا از محيط در نظر نمي گيرد.
آنچه افزايش مي يابد آنتروپي كل است شامل محيط و سيستم. ممكن است در بخشهايي از
سيستم شاهد كاهش آنتروپي ودر نتيجه افزايش نظم باشيم اما بي ترديد در جايي ديگر با افزايش
بيشتري در ميزان بي نظمي روبرو خواهيم بود. "مي توان نشان داد كه تمركز نظم در يك نقطه به
قيمت افزايش بي نظمي در نقطه اي ديگر است.آنچه از تئوري و آزمايشات بر مي آيند نشان مي
دهند كه در كل هر سيستم مقدار افزايش بي نظمي بيشتر از كاهش آن است و از اين رو مجموعاً
در هر فرايندي مقدار بي نظمي(آنتروپي) زياد مي گردد." در يك تحليل آماري مي توان به اين نتيجه
رسيد كه همواره تعداد حالات بي نظم يك سيستم بسيار پرشمارتر از حالات منظم آن اند. "تكه
هاي يك عكس را درون يك جعبه در نظر بگيريد. اين تكه ها در يك و تنها يك آرايش تصويري كامل
مي سازند.
از سويي ديگر آرايشهاي بسيار زيادي هستند كه تصويرچيزي را درست نمي كنند و تكه هاي عكس
در حالت بي نظمي به سر مي برند. هر چه جعبه را بيشتر تكان بدهيم تعداد آرايشهاي درهم و
برهم كه بيانگر هيچ تصويري نباشند بيشتر مي گردد. از ديدگاه آماري احتمال اينكه يك فرايند در
جهت كاهش آنتروپي پيش رود صفر نيست. به بيان ديگر امكان بروز چنين حالتي به قدري كم
است كه گويي غير ممكن است. اما نمي توان صراحتاً گفت كه هيچ امكاني براي آن متصور
نيست.جعبه اي را كه حاوي يك گاز و در تعادل ترموديناميكي است در نظر مي گيريم.
طبق تعريف, گاز موجود در جعبه حداكثر آنتروپي ممكن را خواهد داشت. نظر به اينكه همه مولكول
ها به طور مداوم در حركتند احتمال اينكه مولكولهاي هوا به شكل خاصي قرار بگيرند و مثلا همه
در يك گوشه جعبه متمركز شوند وجود دارد ولي اين احتمال فوق العاده كم است.
يعني از ميليارد ميليارد حالتي كه اين مولكولها مي توانند داشته باشند تنها يك حالت ممكن است
آن حالت منظم مورد نظر ما باشد كه آنتروپي كمتري دارداحتمال چنين اتفاقي تقريباً صفر است.
واقعيت اين است كه از نظر رياضي اين امكان وجود دارد كه چنان آرايش منظمي اتفاق بيفتد
ولي احتمال آن فوق العاده كوچك است.
افزايش بي نظمي و مرگ حرارتي (Heat death)
يكي از تعابيري كه با اعمال قانون دوم ترموديناميك به كل جهان به دست مي آيد اين است كه
جهان در آغاز پيدايش, آنتروپي مشخصي داشته است ولي مقدار آن رفته رفته افزايش پيدا كرده
است.اين افزايش آنتروپي تا جايي ادامه پيدا مي كند كه جهان به حالت تعادل ترموديناميكي
برسد. آنگاه از فعاليت باز خواهد ماند و هيچ اتفاقي در آن به وقوع نخواهد پيوست و به اصطلاح
خواهد مرد. اين فرايند به مرگ حرارتي (Heat death) جهان معروف است. چنين استدلال مي
شود كه "با فرض اينكه جهان در آغاز خلقت در يك حالت كاملاً نامنظم و هرج و مرج كامل و تعادل
ترموديناميكي بوده باشد احتمال اينكه به طور اتفاقي يك جهان منظم ايجاد شده باشد فوق العاده
كم است.
پس بايد خالقي باشد كه علاوه بر خلق همان جهان نامنظم آغازين, يكي از ميلياردها ميليارد
حالت را برگزيند تا جهاني منظم مانند آنچه ما شاهدش هستيم به وجود آيد." نظريات مخالفي
هم وجود دارد كه بيان مي دارند جهان مي توانست در يك مدت طولاني در حالت تعادل ترموديناميكي
باقي بماند. در چنان وضعيتي بالاخره لحظه اي مي رسيد كه در گوشه اي به طور اتفاقي نظم
به وجود بيايد. "اگرمدت ماندن جهان در حالت تعادل ترموديناميكي واقعاً بلند باشد احتمال آن
افزايش مي يابد. خصوصاً اگر جهان را ازلي بدانيم ديگرمشكلي ازنظر زمان طولاني نخواهيم داشت.
يكي از مشهورترين افرادي كه وجود خالقي براي نظم دادن را لازم نمي بيند فيزيكدان مشهور
آلماني بولتزمن(boltzmann) است." جهت افزايش بي نظمي به بياني همان پيكان زمان است
كه فقط در يك سو جريان دارد. يعني تغييرحالت سيستم از يك حالت كم احتمال به يك حالت
پر احتمال. ديدگاههايي كه به پايان جهان در حالت تعادل ترموديناميكي و بي نظمي حداكثر
معتقدند ابراز مي دارند كه چون جهان به سوي بي نظمي و هرج و مرج مي رود و مقدار بي
نظمي آن روز به روز افزايش مي يابد پس به همين دليل مي توان پيش بيني كرد كه جهان
هستي روزي به يك مقدار ماكزيمم در بي نظمي رسيده و فرو مي پاشد. اين تعبير طرفداران
بي شماري دارد زيرا پيش بيني فرجام محتوم جهان خلقت در حالت مرگ و زوال مستلزم اين
است كه جهان هستي, ازلي و بي آغاز نبوده بنابراين آغاز و آفرينشي در كار بوده و بدين ترتيب
از اين امر, وجود خدا را استنتاج مي كنند. در اينجا لازم است پديدهء مرگ و زوال از ديدگاه
ترموديناميكي تبيين شود."از جمله تواناييهاي جالب تمام موجودات زنده خودساختاردهي است.
بدين معني كه ما براي ادامه زندگي, مدام به نظم دادن به ساختارهاي بي نظم خود مي پردازيم.
البته اين فرايند مستلزم صرف انرژي و در نتيجه افزايش ناخواسته آنتروپي و ميزان بي نظمي
ساختارمان است. موجودات زنده براي زنده ماندن به تغذيه و تنفس نياز دارند. "مواد غذايي
ساختاري پيچيده و منظم دارند و آنتروپي آنها پايين است. هر سيستمي كه آنتروپي پاييني
داشته باشدانرژي متمركز يا مفيد بيشتري دارد و لذا انرژي مفيد مواد غذايي بالاست.و اين
مهمترين مشخصه آنهاست. بنابراين تغذيه و تنفس براي يك موجود زنده عبارتست از وارد
كردن مواد كم آنتروپي به بدن و در نهايت پايين آوردن آنتروپي كل و طولاني كردن عمر" از اين
رو زماني كه موجود زنده اي در ارتباط با محيط نباشد زمان زيادي طول نمي كشد كه كليه
حركاتش تحت ﺘﺄثير اصطكاك و ساير عوامل برگشت ناپذيري كه به افزايش آنتروپي مي انجامند
متوقف شده توزيع دما در سرتاسر بدن موجود زنده يكنواخت گردد و در ادامه موجود زنده به
يك تعادل ترموديناميكي برسد كه مرگ خوانده مي شود. ما براي ادامه دادن به حيات خود,
سعي مي كنيم سرعت رسيدن به تعادل ترموديناميكي را كندتر كنيم و اجازه ندهيم تا آنتروپي
و بي نظمي بدن مان به مقدار ماكزيمم خود برسد. اما همواره مقدار انرژي مصرفي بدن
موجود زنده, بيشترازانرژي كسب شده آن است و در نتيجه بي نظمي يك سيستم زنده
بي ترديد به يك مقدار حداكثري مي رسد.
مانند تمام رويدادهاي طبيعت كه با افزايش آنتروپي همراهند, آنتروپي موجود زنده نيز به دليل
خودساختاردهي (كه براي كند كردن روند رسيدن به تعادل صورت مي گيرد) مدام در حال
افزايش است. بنابراين مرگ, همان رسيدن به حالت تعادل ترموديناميكي يا مقدار ماكزيمم
بي نظمي براي بدن موجود زنده است.
چند مغالطه در استنتاج امتناع حيات جاودانه جهان
اما استدلال كساني كه مرگ جهان و رسيدن آن به حداكثر آنتروپي را از اصل افزايش آنتروپي
استنتاج كرده اند در برگيرندهء چند مغالطهء آشكار است. اولين آن مغالطه" تعويض وجه با كنه"
يا "چهره با كل" (مغالطهء هيچ نيست بجز, nothing but) است. بدين معني كه گفته نمي شود
كدام وجه جهان در جهت نابودي و فروپاشي پيش مي رود.
و مثلاً آيا اين امر براي وجوه ديگر جهان مثلا تنوع گونه هاي زيستي هم صادق است يا خير. آيا
كل جهان را ميتوان بعنوان يك سيستم در نظر گرفت ؟
آيا مجموعه همه سيستمها خود يك سيستم است؟ (مي دانيم كه چنين نيست مثلا مجموعه
چند حرف كنار يكديگر, ديگر حرف نيست بلكه كلمه است). چگونه مي توانيم همان قواعدي را
كه براي اجزا به كار مي بريم براي كل نيزاستفاده كنيم؟ آيا مجاز به چنين استنتاجي از مشاهده
وضع كنوني جهان و اصل افزايش آنتروپي ميباشيم؟ قطعاً پاسخ به چنين پيشگويي قاطعانه اي
از فرجام جهان, منفي است. در چنين جهاني هيچ جايي براي ارادهء آزاد باقي نمي ماند و هر
چيزي از پيش تعيين شده خواهد بود. اما در نظر گرفتن مساله فوق با همان مغالطه تعويض
وجه با كنه نيز "مستلزم اين نخواهد بود كه مقدار آنتروپي هيچگونه حد كمترين يا بيشتريني
داشته باشد و مقدار آنتروپي مي تواند تا بي نهايت ادامه پيدا كند و هيچ مقدار حداكثري هم
نداشته باشد" با اين تفاسير ,استنتاج امتناع حيات جاودانه براي كل جهان ازاصل افزايش آنتروپي
غيرقابل قبول است. دوئم (Pierre duhem) ميگويد:" ما ترموديناميكي در اختيار داريم كه عده اي
از قوانين تجربي را به خوبي حكايت مي كند و به ما مي گويد كه آنتروپي يك سيستم ايزوله
در افزايش جاودانه است. بدون هيچ دشواري مي توان ترموديناميك ديگري ساخت كه به همان
خوبي ترموديناميك قديم, حاكي از قوانين تجربي معلوم شده تا حال باشد و پيش بيني هايش
هم براي ده هزار سال آينده با پيشگويي هاي ترموديناميك قديم همگام و موافق باشد. و در
عين حال اين ترموديناميك نوين ممكن است به ما بگويد كه آنتروپي جهان پس از اينكه ظرف
صد مليون سال آينده افزايش مي يابد براي صد مليون سال بعد ازآن مرتباً و متوالياً كاهش
خواهد يافت و سپس دوباره افزايش خواهد يافت و... ,
علم تجربي به مقتضاي طبع از پيش بيني انتهاي جهان و ادعا درباره فعاليت دائم آن عاجز
است" ثانياً براي يك پيشگويي علمي همواره براي حصول نتيجه بايد يك قانون كلي داشته
باشيم به اضافه قضاياي مخصوصه كه اين دو در كنار يكديگر, مقدمات تفسير را شكل مي دهند."
درهر تفسير قياسي وجود يك قانون كلي به انضمام شرايط خاص حادثه ضروريست. بعبارت
ديگراستنتاج نتيجه از يك تك مقدمه غيرممكن است.
از قانون دوم ترموديناميك و به تبع آن از اصل افزايش آنتروپي, نمي توان رسيدن كل جهان را
به حالت ماكزيمم بي نظمي را استنتاج نمود به اين دليل كه شرايط خاص حادثه(Initial conditions)
را در دست نداريم وبدون هيچگونه مدرك مستدلي, آن را معلوم فرض كرده ايم .
در ثاني پيشاپيش فرض كرده ايم كه همه تجربيات آينده از مشاهدات ترموديناميكي به همين
صورت كنوني باقي خواهد ماند و آنگاه اين موضوع را كه اصل افزايش آنتروپي به مرگ جهان
مي انجامد, پيش بيني كرده ايم. بنابراين مقدمات اين تفسير,ناقص هستند.از اين رو طرح
اين مساله كه از قانون دوم ترموديناميك, امتناع حيات جاودانه جهان استنتاج مي شود چند
ايراد منطقي از جمله مغالطه تعويض وجه با كنه, و پيش فرضهاي تجربه ناپذير را در بر مي گيرد.