You are using an out of date browser. It may not display this or other websites correctly.
You should upgrade or use an alternative browser.
You should upgrade or use an alternative browser.
سرطان وسلول های بنیادی
- شروع کننده موضوع orkidehm
- تاریخ شروع
جداسازی سلول های بنیادی از بافت کلیه
جداسازی سلول های بنیادی از بافت کلیه
پژوهشگران دانشگاه علوم پزشکی تهران موفق به جداسازی سلول بنیادی با مارکر ویژه از بافت کلیه شدند.
به گزارش مهر ، دکتر عباسی مجری طرح با اعلام این خبر ، افزود: در این پژوهش که با مشارکت گروهی از اساتید و دانشجویان طراحی شد از بافت کلیه افرادی که مبتلا به کانسر (سرطان) کلیه از نوع کارسینوم سلول کلیوی (RCC) بودند و باید تحت عمل نفرکتومی (خارج شدن کلیه) قرار می گرفتند، استفاده شد.
وی افزود: این کلیه های سرطانی دارای بافت زنده سالم نیز بود و به همین دلیل تیم پژوهشی با طی مراحل قانونی و جلب رضایت بیماران و طی مراحل اخلاقی، بخش کوچکی از پاپیلای این کلیه ها را برداشت و سلول بنیادی در این بافتها را مورد جستجو قرار داد و پس از مدتی سلول بنیادی در این بافتها دیده شد.
عضو هیئت علمی دانشگاه علوم پزشکی تهران اضافه کرد: این سلولها کشت داده شد و به موش تزریق شد و پس از آن دیده شد که این سلولهای بنیادی قابلیت ساختن توبولهای کلیوی، استخوان و بعضی بافتهای دیگر را دارد و در واقع ویژگی های سلول بنیادی را داشت.
وی یادآور شد: پس از آن این سوال مطرح شد که ممکن است این سلولهای بنیادی از خون به داخل بافت کلیه آمده باشند و برای پاسخ به این سوال مارکرهای آنتی ژنتیک این سلولها مورد مطالعه قرار گرفت و مشخص شد این مارکرها با مارکرهای سطح سلولهای بنیادی خون متفاوت است و مشخص شد که از منشاء خونی نیست.
عباسی گفت: سوال بعدی این بود که خوب چه تضمینی هست که این سلول بنیادی مربوط به خود بافت کلیه باشد و جزو سلولهای سازنده بخشی از بافتهای کلیه باشد و برای پاسخ به این سوال بررسی های مختلفی صورت گرفت و شاخصهای آنتی ژنتیک بافت کلیه فرد بالغ در این سلولها دیده شد که آن را از سلولهای بنیادی جنینی متمایز می کند.
وی خاطرنشان کرد: پس از این بررسی ها به این نتیجه رسیدیم که سلول بنیادی جدا شده از منشاء هماتولوژیک نبوده و سلول بنیادی است که قابلیت ساخت بخشی از سلولهای کلیوی را داراست.
عضوگروه نفرولوژی بیمارستان امام خمینی (ره) تأکید کرد: دستیابی به این دستاورد مهم است اما تا ساخت کلیه فاصله جدی وجود دارد و در این مرحله تنها می توان به دستاوردهای پژوهشی و نه درمانی امیدوار بود و تنها می توان امیدوار بود که جدا سازی این سلولها ما را در جهت شناخت مبانی بیماری شناسی بعضی بیماریها کمک کند.
وی خاطرنشان کرد: این بافت کلیوی بافتی پیچیده است که ممکن است با تکامل چندین سلول بنیادی در مسیرهای مختلف بوجود آمده باشد و لذا دستیابی به ساخت کلیه در این مرحله از پروژه مد نظر نیست.
این پژوهش با مشارکت گروهی از اساتید دانشگاه علوم پزشکی تهران از جمله دکتر آیتی رئیس بخش ارولوژی، دکتر امامی رضوی رئیس دانشکده پزشکی و دکتر خوش زبان مسئول بانک فرآورده های پیوندی، زاهد دانشجوی پزشکی ، حیدری کارشناس ارشد بیولوژی سلولی و دکتر عباسی در پروژه ای به صورت پایان نامه دکتری برای دستیابی به سلول بنیادی بافت کلیه طراحی شد.
منبع
جداسازی سلول های بنیادی از بافت کلیه
پژوهشگران دانشگاه علوم پزشکی تهران موفق به جداسازی سلول بنیادی با مارکر ویژه از بافت کلیه شدند.
به گزارش مهر ، دکتر عباسی مجری طرح با اعلام این خبر ، افزود: در این پژوهش که با مشارکت گروهی از اساتید و دانشجویان طراحی شد از بافت کلیه افرادی که مبتلا به کانسر (سرطان) کلیه از نوع کارسینوم سلول کلیوی (RCC) بودند و باید تحت عمل نفرکتومی (خارج شدن کلیه) قرار می گرفتند، استفاده شد.
وی افزود: این کلیه های سرطانی دارای بافت زنده سالم نیز بود و به همین دلیل تیم پژوهشی با طی مراحل قانونی و جلب رضایت بیماران و طی مراحل اخلاقی، بخش کوچکی از پاپیلای این کلیه ها را برداشت و سلول بنیادی در این بافتها را مورد جستجو قرار داد و پس از مدتی سلول بنیادی در این بافتها دیده شد.
عضو هیئت علمی دانشگاه علوم پزشکی تهران اضافه کرد: این سلولها کشت داده شد و به موش تزریق شد و پس از آن دیده شد که این سلولهای بنیادی قابلیت ساختن توبولهای کلیوی، استخوان و بعضی بافتهای دیگر را دارد و در واقع ویژگی های سلول بنیادی را داشت.
وی یادآور شد: پس از آن این سوال مطرح شد که ممکن است این سلولهای بنیادی از خون به داخل بافت کلیه آمده باشند و برای پاسخ به این سوال مارکرهای آنتی ژنتیک این سلولها مورد مطالعه قرار گرفت و مشخص شد این مارکرها با مارکرهای سطح سلولهای بنیادی خون متفاوت است و مشخص شد که از منشاء خونی نیست.
عباسی گفت: سوال بعدی این بود که خوب چه تضمینی هست که این سلول بنیادی مربوط به خود بافت کلیه باشد و جزو سلولهای سازنده بخشی از بافتهای کلیه باشد و برای پاسخ به این سوال بررسی های مختلفی صورت گرفت و شاخصهای آنتی ژنتیک بافت کلیه فرد بالغ در این سلولها دیده شد که آن را از سلولهای بنیادی جنینی متمایز می کند.
وی خاطرنشان کرد: پس از این بررسی ها به این نتیجه رسیدیم که سلول بنیادی جدا شده از منشاء هماتولوژیک نبوده و سلول بنیادی است که قابلیت ساخت بخشی از سلولهای کلیوی را داراست.
عضوگروه نفرولوژی بیمارستان امام خمینی (ره) تأکید کرد: دستیابی به این دستاورد مهم است اما تا ساخت کلیه فاصله جدی وجود دارد و در این مرحله تنها می توان به دستاوردهای پژوهشی و نه درمانی امیدوار بود و تنها می توان امیدوار بود که جدا سازی این سلولها ما را در جهت شناخت مبانی بیماری شناسی بعضی بیماریها کمک کند.
وی خاطرنشان کرد: این بافت کلیوی بافتی پیچیده است که ممکن است با تکامل چندین سلول بنیادی در مسیرهای مختلف بوجود آمده باشد و لذا دستیابی به ساخت کلیه در این مرحله از پروژه مد نظر نیست.
این پژوهش با مشارکت گروهی از اساتید دانشگاه علوم پزشکی تهران از جمله دکتر آیتی رئیس بخش ارولوژی، دکتر امامی رضوی رئیس دانشکده پزشکی و دکتر خوش زبان مسئول بانک فرآورده های پیوندی، زاهد دانشجوی پزشکی ، حیدری کارشناس ارشد بیولوژی سلولی و دکتر عباسی در پروژه ای به صورت پایان نامه دکتری برای دستیابی به سلول بنیادی بافت کلیه طراحی شد.
منبع
پژوهشگران علوم پزشکی می گویند نتایج تحقیقات آنان نشان داده است که سلول های بنیادی بیش از دو هفته در جسد به صورت غیرفعال باقی می مانند و سپس برای تقسیم شدن به سلول های جدید دوباره فعال می شوند.به گزارش خبرنگار سایت پزشکان بدون مرز ، این تحقیق به درک بیشتر توانایی سلول های بنیادی برای تبدیل شدن به بافت های مختلف بدن و نقش آنها در ترمیم بافت های آسیب دیده کمک می کند. محققین اعلام کردند که سلول های بنیادی ۱۷ روز در جسد زنده می مانند
به گفته محققان، سلول های بنیادی عضلانی اسکلتی می توانند در جسد انسان مدت ۱۷ روز و در جسد موش ۱۶ روز زنده بمانند.
محققان متوجه شدند که سلول های بنیادی توانایی خود را برای تبدیل شدن به سلول های عضلانی حفظ می کنند.
محققان موسسه پاستور دریافتند که سلول های بنیادی عضلانی اسکلتی برای زنده ماندن در شرایط دشوار، متابولیسم خود را پایین می آورند تا انرژی کمتری مصرف کنند و وارد وضعیت نهفته شوند.
این گروه همچنین سلول های بنیادی گرفته شده از مغز استخوان (جایی که سلول های خونی تولید می شود) بررسی کردند.
محققان متوجه شدند که سلول های بنیادی ناشی از مغز استخوان چهار روز پس از مرگ موش آزمایشگاهی زنده می ماند و توانایی خود را برای ساخت بافت پس از پیوند مغز استخوان حفظ می کند.
محققان گفتند: با برداشت سلول های بنیادی از مغز استخوان اهدا کننده ی مرده، پزشکان می توانند تا حدودی کمبود بافت ها و سلول ها را جبران کنند.
به گفته محققان، سلول های بنیادی عضلانی اسکلتی می توانند در جسد انسان مدت ۱۷ روز و در جسد موش ۱۶ روز زنده بمانند.
محققان متوجه شدند که سلول های بنیادی توانایی خود را برای تبدیل شدن به سلول های عضلانی حفظ می کنند.
محققان موسسه پاستور دریافتند که سلول های بنیادی عضلانی اسکلتی برای زنده ماندن در شرایط دشوار، متابولیسم خود را پایین می آورند تا انرژی کمتری مصرف کنند و وارد وضعیت نهفته شوند.
این گروه همچنین سلول های بنیادی گرفته شده از مغز استخوان (جایی که سلول های خونی تولید می شود) بررسی کردند.
محققان متوجه شدند که سلول های بنیادی ناشی از مغز استخوان چهار روز پس از مرگ موش آزمایشگاهی زنده می ماند و توانایی خود را برای ساخت بافت پس از پیوند مغز استخوان حفظ می کند.
محققان گفتند: با برداشت سلول های بنیادی از مغز استخوان اهدا کننده ی مرده، پزشکان می توانند تا حدودی کمبود بافت ها و سلول ها را جبران کنند.
| به گزارش شینهوا، این مطالعه كه توسط دانشمندان دانشگاه بریتیش كلمبیا و واحد تحقیق وتوسعه 'جانسن' در نیوجرسی انجام شده است می تواند راه را برای ارائه درمان نوینی برای دیابت هموار سازد. در این شیوه محققان مشاهده كردند پس از پیوند سلول های بنیادی، موش های مبتلا به دیابت شروع به تولید انسولین كردند . سه تا چهار ماه بعد، این موش ها حتی زمانی كه میزان زیادی قند به آنها داده شد توانستند میزان قند خون را حفظ كنند. دكتر 'تیموتی كفر' یكی از 13 محقق این پروژه با ابراز شگفتی از نتایج به دست آمده اظهار داشت: باید پیش از آزمایش بالینی این شیوه بر روی انسان، تحقیقات بیشتری صورت گیرد. كفر افزود: این بررسی ها بر روی موش ها مبتلا به دیابت انجام شد كه از سیستم ایمنی با عملكرد مناسب بی بهره بودند؛این در حالی است كه اگر سیستم ایمنی این جوندگان وضعیت مطلوبی داشت ممكن بود سلول های بنیادی انسانی را پس بزنند. وی ادامه داد: اكنون باید شیوه مناسبی برای حفاظت از سلول های بنیادی در برابر حمله سیستم ایمنی یافت تا پیوند این سلول ها هیچگونه واكنش ایمنی در بر نداشته باشد. نتایح این تحقیقات درنشریه دیابت منتشر شده است. |
دانشمندان موفق به پرورش غدد عرق از سلولهاي بنيادي شدند
دانشمندان موفق به پرورش غدد عرق از سلولهاي بنيادي شدند
محققان دانشگاه راكفلر و مؤسسه پزشكي هاروارد هاگز، موفق به شناسايي سلولهاي بنيادي در موشها شدند كه غدد عرق ابتدا از آنها توليد شدند.
به گزارش سرويس علمي ايسنا تا به امروز اصول كمي در مورد رايجترين غده در بدن كه همان غدد عرق هستند، شناخته شده كه نقش مهمي در كنترل دماي بدن داشته و به انسان در زندگي در آبوهواي متنوع جهان كمك ميكند.
دانشمندان در پژوهش خود كه در مجله Cell منتشر شده، از يك استراتژي براي خالص كردن و شناسايي خصوصيات مولكولي انواع مختلف جمعيتهاي سلول بنيادي استفاده كردند كه به ساخت مجراي پيچيده عرق و غدد پوستي ميپردازند.
اين محققان با اين اطلاعات چگونگي واكنش اين جمعيتهاي متفاوت سلولهاي بنيادي به هموستاز بافت عادي و به انواع مختلف آسيبهاي پوستي و همچنين چگونگي تفاوت غدد عرق از غدد پستاني را مورد بررسي قرار دادند.
به گفته دانشمندان، سلولهاي بنيادي غدد پستاني به القاي هورموني با گسترش زياد بافت غدهاي براي افزايش توليد شير واكنش نشان ميدهد. در مقابل، در طول يك مسابقه ماراتن، سلولهاي بنيادي غده عرق تا ميزان زيادي خفته ميماند. خروجي غدهاي بجاي گسترش بافت پاسخگوي سه ليتر عرق بدن انسان است. اين تفاوتهاي جالب در فعاليت سلولهاي بنيادي و توليد بافت احتمالا دليل شايعتر بودن سرطان پستان و نادرتر بودن سرطان غده عرق هستند.
يافتههاي اين دانشمندان همچنين ميتواند در آينده به ارتقاي درمانهايي براي افرادي كه خيلي زياد يا كم تعرق دارند، كمك كند.
هر انسان از ميليونها غده عرق برخوردار است، اما تاكنون مطالعات بسيار كمي به دليل سختي جمعآوري اين اندام ريز در آزمايشگاه براي بررسي بيشتر آنها انجام شده است. بطور سنتي از موشها به عنوان مدلي براي مطالعات غدد عرق انساني استفاده شده، بنابراين در اين پروژه نيز اين محققان با تلاش بيوقفه به استخراج غدد عرق از پنجههاي موش پرداختند.
اين محققان در پي پاسخ به اين پرسش بودند كه آيا سلولهاي مختلف سازنده غده و مجراي عرق، از سلولهاي بنيادي برخوردارند كه ميتوانند به ترميم غدد آسيبديده بزرگسال كمك كنند؟
آنها دريافتند كه پيش از تولد، مجراي نوپاي عرق از سلولهاي بنيادي پوست برونی شكل گرفته كه همچنين به پرورش غدد پستاني، فوليكولهاي مو و بسياري از زوائد مخاطي ديگر ميپردازد. با رشد هر مجرا در عمق پوست، يك غده عرق در پايه آن ايجاد ميشود.
محققان سپس به جستوجو براي سلولهاي بنيادي در غدد عرق بزرگسالان و لايه داخلي مجرايي پرداختند. غده از دو لايه ساخته شده كه سلولها در آن به توليد عرق و لايه بيروني سلولهاي سبدی يا ميواپيتليال به فشردن مجرا براي تخليه عرق ميپردازند.
محققان به ايجاد يك استراتژي براي الصاق يك برچسب فلورسنت براي جستوجوي جمعيتهاي متفاوت سلولهاي مجرايي و غددي پرداخته و هر جمعيت از سلولهاي خالص شده را به نواحي مختلف بدون موش ماده گيرنده براي مشاهده عملكرد آنها تزريق كردند.
جالب اينكه هنگامي كه سلولهاي سبدي غده عرق به پدهاي چربي پستاني معرفي شدند، به توليد ساختارهاي فلورسنت شبيه به غدد عرق پرداختند.
به گفته محققان، هر غده از توزیع قطبی مناسب سلولهاي مجرايي و سبدي برخوردار بوده و همچنين به توليد پروتئينهاي شبكه سديم پتاسيوم پرداختند كه معمولا در غدد عرق بزرگسال و نه غدد پستاني ابراز ميشوند.
هنگامي كه موش ماده باردار شد، برخي از غدد عرق فلورسنت شروع به توليد شير كردند در حاليكه هنوز از برخي خصوصيات غده عرق نيز برخوردار بودند. جالبتر اين كه سلولهاي سبدي غده عرق هنگامي كه در پوست پشت موش قرار گرفتند، به توليد پوست بروني پرداختند.
طبق نتاج محققان، سلولهاي بنيادي غددي از ويژگيهاي خاص برخوردارند كه آنها را قادر به يادآوري محلشان در برخي محيطها و همچنين سازگاري با ويژگيهاي جديد در ديگر محيطها ميكند.
از اين يافتهها ميتوان براي بررسي ريشه برخي اختلالات ژنتيكي كه بر غدد عرق تاثير گذاشته و همچنين راههايي براي درمان احتمالي آنها استفاده كرد.
دانشمندان موفق به پرورش غدد عرق از سلولهاي بنيادي شدند
محققان دانشگاه راكفلر و مؤسسه پزشكي هاروارد هاگز، موفق به شناسايي سلولهاي بنيادي در موشها شدند كه غدد عرق ابتدا از آنها توليد شدند.
به گزارش سرويس علمي ايسنا تا به امروز اصول كمي در مورد رايجترين غده در بدن كه همان غدد عرق هستند، شناخته شده كه نقش مهمي در كنترل دماي بدن داشته و به انسان در زندگي در آبوهواي متنوع جهان كمك ميكند.
دانشمندان در پژوهش خود كه در مجله Cell منتشر شده، از يك استراتژي براي خالص كردن و شناسايي خصوصيات مولكولي انواع مختلف جمعيتهاي سلول بنيادي استفاده كردند كه به ساخت مجراي پيچيده عرق و غدد پوستي ميپردازند.
اين محققان با اين اطلاعات چگونگي واكنش اين جمعيتهاي متفاوت سلولهاي بنيادي به هموستاز بافت عادي و به انواع مختلف آسيبهاي پوستي و همچنين چگونگي تفاوت غدد عرق از غدد پستاني را مورد بررسي قرار دادند.
به گفته دانشمندان، سلولهاي بنيادي غدد پستاني به القاي هورموني با گسترش زياد بافت غدهاي براي افزايش توليد شير واكنش نشان ميدهد. در مقابل، در طول يك مسابقه ماراتن، سلولهاي بنيادي غده عرق تا ميزان زيادي خفته ميماند. خروجي غدهاي بجاي گسترش بافت پاسخگوي سه ليتر عرق بدن انسان است. اين تفاوتهاي جالب در فعاليت سلولهاي بنيادي و توليد بافت احتمالا دليل شايعتر بودن سرطان پستان و نادرتر بودن سرطان غده عرق هستند.
يافتههاي اين دانشمندان همچنين ميتواند در آينده به ارتقاي درمانهايي براي افرادي كه خيلي زياد يا كم تعرق دارند، كمك كند.
هر انسان از ميليونها غده عرق برخوردار است، اما تاكنون مطالعات بسيار كمي به دليل سختي جمعآوري اين اندام ريز در آزمايشگاه براي بررسي بيشتر آنها انجام شده است. بطور سنتي از موشها به عنوان مدلي براي مطالعات غدد عرق انساني استفاده شده، بنابراين در اين پروژه نيز اين محققان با تلاش بيوقفه به استخراج غدد عرق از پنجههاي موش پرداختند.
اين محققان در پي پاسخ به اين پرسش بودند كه آيا سلولهاي مختلف سازنده غده و مجراي عرق، از سلولهاي بنيادي برخوردارند كه ميتوانند به ترميم غدد آسيبديده بزرگسال كمك كنند؟
آنها دريافتند كه پيش از تولد، مجراي نوپاي عرق از سلولهاي بنيادي پوست برونی شكل گرفته كه همچنين به پرورش غدد پستاني، فوليكولهاي مو و بسياري از زوائد مخاطي ديگر ميپردازد. با رشد هر مجرا در عمق پوست، يك غده عرق در پايه آن ايجاد ميشود.
محققان سپس به جستوجو براي سلولهاي بنيادي در غدد عرق بزرگسالان و لايه داخلي مجرايي پرداختند. غده از دو لايه ساخته شده كه سلولها در آن به توليد عرق و لايه بيروني سلولهاي سبدی يا ميواپيتليال به فشردن مجرا براي تخليه عرق ميپردازند.
محققان به ايجاد يك استراتژي براي الصاق يك برچسب فلورسنت براي جستوجوي جمعيتهاي متفاوت سلولهاي مجرايي و غددي پرداخته و هر جمعيت از سلولهاي خالص شده را به نواحي مختلف بدون موش ماده گيرنده براي مشاهده عملكرد آنها تزريق كردند.
جالب اينكه هنگامي كه سلولهاي سبدي غده عرق به پدهاي چربي پستاني معرفي شدند، به توليد ساختارهاي فلورسنت شبيه به غدد عرق پرداختند.
به گفته محققان، هر غده از توزیع قطبی مناسب سلولهاي مجرايي و سبدي برخوردار بوده و همچنين به توليد پروتئينهاي شبكه سديم پتاسيوم پرداختند كه معمولا در غدد عرق بزرگسال و نه غدد پستاني ابراز ميشوند.
هنگامي كه موش ماده باردار شد، برخي از غدد عرق فلورسنت شروع به توليد شير كردند در حاليكه هنوز از برخي خصوصيات غده عرق نيز برخوردار بودند. جالبتر اين كه سلولهاي سبدي غده عرق هنگامي كه در پوست پشت موش قرار گرفتند، به توليد پوست بروني پرداختند.
طبق نتاج محققان، سلولهاي بنيادي غددي از ويژگيهاي خاص برخوردارند كه آنها را قادر به يادآوري محلشان در برخي محيطها و همچنين سازگاري با ويژگيهاي جديد در ديگر محيطها ميكند.
از اين يافتهها ميتوان براي بررسي ريشه برخي اختلالات ژنتيكي كه بر غدد عرق تاثير گذاشته و همچنين راههايي براي درمان احتمالي آنها استفاده كرد.
به گزارش دانشگاه علوم پزشكی تهران ، دكتر'مرتضی كروجی ' عضو هیات علمی دانشگاه علوم پزشكی تهران در گروه آناتومی و مركز تحقیقات سلولی و مولكولی در این مورد گفت : نیمی از موارد ناباروری به دلیل فاكتورهای مردانه است كه 10 درصد از این موارد ناباروری به دلیل بیماری آزواسپرم است .وی افزود: بیماری آزواسپرمی غیرانسدادی در واقع نارسایی بیضه به دلایل مختلف است كه در آن اسپرم سازی به طور كامل و یا تا حد زیادی متوقف می شود و فقط كانونهای معدودی از بیضه فعال هستند.به گفته این پزشك متخصص ، این بیماری (آزواسپرمی غیرانسدادی ) یكی از علل نسبتا شایع ناباروری مردان است .در بیوپسی بیماران آزواسپرمی غیرانسدادی، به رغم بیوپسی های متعدد از هر دو بیضه، در 40 درصد موارد نمی توان اسپرمی كه مناسب عمل میكرواینجكشن ICSI باشد ، به دست آورد.وی خاطرنشان كرد: در درمان این گروه بیماران می توان به فرضیه تمایز سلولهای بنیادی اسپرماتوگونی در شرایط آزمایشگاه و تولید اسپرم و یا احتمالا پیوند این سلولها به بیضه فرد بیمار ازواسپرم در آینده اشاره كرد.وی ادامه داد: این طرح پیش از این در حد فرضیه مطرح بوده است ونیاز به مطالعات بیشتر در آینده دارد. مقدمه آن جدا سازی و تكثیر سلولهای بنیادی اسپرماتوگونی این افراد در محیط ازمایشگاه بود كه به تازگی این كار انجام شده است. اگرچه مطالعات بر روی تكثیر برای حیوان بالغ قبلا توسط دانشگاه علوم پزشكی تهران در دانشگاه تربیت مدرس انجام ونتایج آن نیز منتشر شده است ولی مطالعات انسانی از سال 2009 آغاز شده و در حال گسترش است.كروجی ادامه داد: تعداد سلولهای بنیادی اسپرماتوگونی در بیضه فرد بالغ بسیار كم است و تكثیر تعداد كم سلول اولیه حاصل از TESTE مشكل است كه به تازگی محققان ایرانی موفق به این كار شده اند.وی خاطرنشان كرد : نتایج این پژوهش در مجله معتبر J Assist Reprod Genet و با عنوان Proliferation of small number of human spermatogonial stem cells obtained from azoospermic patients. به چاپ رسیده است .كروجی گفت : در این طرح پژوهشی محققان با استفاده از نمونه معمولی و تست بیماران با استفاده از سیستم كشت خاص(استفاده از فاكتورهای رشد مشخص و عناصر ماتریكس خارج سلولی) موفق به تكثیر سلولها شدند كه موفقیت بزرگی در درمان آتی این بیماران محسوب می شود.
نانوحبابها به جنگ سرطان رفتند
نانوحبابها به جنگ سرطان رفتند
محققان دانشگاه رايس درتلاشند با كمك نانوذرات جمعكننده نور براي تبديل انرژي ليزر به نانوحبابهاي پلاسمونيك، روشهاي جديدي را براي تزريق مستقيم دارو و حاملهاي ژنتيكي به درون سلولهاي سرطاني ارائه دهند.
به گزارش سرويس پژوهشي ايسنا، «ديميتري لاپوتكو» و همكارانش در دانشگاه رايس، در آزمايشهايي كه بر روي سلولهاي سرطاني مقاوم به دارو انجام دادند، دريافتند تزريق داروهاي شيمي درماني توسط اين نانوحبابها با 10 درصد دوز معمول، 30 برابر كشندهتر از داروهاي رايج است.
نانوحبابهاي دانشگاه رايس نانوذره نيستند، بعلاوه داراي عمر کوتاهي هستند. اين نانوحبابها بستههاي کوچکي از هوا و بخار آب هستند که از برخورد نور ليزر با خوشهاي از نانوذرات و تبديل فوري آن به گرما تشکيل ميشود.
اين حبابها دقيقا زير سطح سلولهاي سرطان تشکيل ميشوند. زمانيکه اين حبابها منبسط شده و ميترکند، به طور مشخصي روزنههاي کوچکي را بر روي سطح سلول ايجاد كرده و داروي سرطان اجازه مييابد به درون سلول حمله کند. ميتوان از روشهاي مشابه براي تزريق مستقيم داروهاي ژنتيکي و ساير حاملهاي دارويي به درون سلول استفاده كرد.
نانوحبابهاي پلاسمونيک «لاپوتکو» زماني تشکيل ميشود که پالسي از ليزر به پلاسمون (موجي از الکترونها که در سطح نانوذرات فلزي عقب و جلو ميرود) برخورد ميكند.
گروه تحقيقاتي «لاپتکو» با يکسان شدن طول موج ليزر با پلاسمون و دريافت مقدار لازم از انرژي ليزر به اين اطمينان دست يافت که اين نانوحبابها تنها در اطراف خوشههاي نانوذرهاي درون سلولهاي سرطاني شکل ميگيرند.
براي تشکيل اين نانوحبابها پژوهشگران مذکور ابتدا بايد نانوخوشههاي طلا را درون سلولهاي سرطاني قرار دهند. اين دانشمندان اين کار را با چسباندن نانوذرات منفرد طلا به يک پادتن که به سطح سلول سرطاني ميچسبد، انجام دادند. سلولها اين نانوذرات طلا را بلعيده و آنها را در بستههايي جدا از هم دقيقا در زير سطحشان قرار ميدهند.
از آنجا که مقدار کمي از نانوذرات طلا توسط سلولهاي سالم جذب ميشود، سلولهاي سرطاني در معرض خطر بيشتري قرار ميگيرند و انتخابپذيري فرايند مديون اين حقيقت است كه حد پايين انرژي ليزر مورد نياز براي تشكيل نانوحبابها در سلولهاي سرطاني بسيار پايينتر از مقدار آن براي سلولهاي سالم است.
اين پژوهشگران، جزئيات نتايج کار تحقيقاتي خود را در مجلهي «Biamaterials» منتشر کردهاند.
نانوحبابها به جنگ سرطان رفتند
محققان دانشگاه رايس درتلاشند با كمك نانوذرات جمعكننده نور براي تبديل انرژي ليزر به نانوحبابهاي پلاسمونيك، روشهاي جديدي را براي تزريق مستقيم دارو و حاملهاي ژنتيكي به درون سلولهاي سرطاني ارائه دهند.
به گزارش سرويس پژوهشي ايسنا، «ديميتري لاپوتكو» و همكارانش در دانشگاه رايس، در آزمايشهايي كه بر روي سلولهاي سرطاني مقاوم به دارو انجام دادند، دريافتند تزريق داروهاي شيمي درماني توسط اين نانوحبابها با 10 درصد دوز معمول، 30 برابر كشندهتر از داروهاي رايج است.
نانوحبابهاي دانشگاه رايس نانوذره نيستند، بعلاوه داراي عمر کوتاهي هستند. اين نانوحبابها بستههاي کوچکي از هوا و بخار آب هستند که از برخورد نور ليزر با خوشهاي از نانوذرات و تبديل فوري آن به گرما تشکيل ميشود.
اين حبابها دقيقا زير سطح سلولهاي سرطان تشکيل ميشوند. زمانيکه اين حبابها منبسط شده و ميترکند، به طور مشخصي روزنههاي کوچکي را بر روي سطح سلول ايجاد كرده و داروي سرطان اجازه مييابد به درون سلول حمله کند. ميتوان از روشهاي مشابه براي تزريق مستقيم داروهاي ژنتيکي و ساير حاملهاي دارويي به درون سلول استفاده كرد.
نانوحبابهاي پلاسمونيک «لاپوتکو» زماني تشکيل ميشود که پالسي از ليزر به پلاسمون (موجي از الکترونها که در سطح نانوذرات فلزي عقب و جلو ميرود) برخورد ميكند.
گروه تحقيقاتي «لاپتکو» با يکسان شدن طول موج ليزر با پلاسمون و دريافت مقدار لازم از انرژي ليزر به اين اطمينان دست يافت که اين نانوحبابها تنها در اطراف خوشههاي نانوذرهاي درون سلولهاي سرطاني شکل ميگيرند.
براي تشکيل اين نانوحبابها پژوهشگران مذکور ابتدا بايد نانوخوشههاي طلا را درون سلولهاي سرطاني قرار دهند. اين دانشمندان اين کار را با چسباندن نانوذرات منفرد طلا به يک پادتن که به سطح سلول سرطاني ميچسبد، انجام دادند. سلولها اين نانوذرات طلا را بلعيده و آنها را در بستههايي جدا از هم دقيقا در زير سطحشان قرار ميدهند.
از آنجا که مقدار کمي از نانوذرات طلا توسط سلولهاي سالم جذب ميشود، سلولهاي سرطاني در معرض خطر بيشتري قرار ميگيرند و انتخابپذيري فرايند مديون اين حقيقت است كه حد پايين انرژي ليزر مورد نياز براي تشكيل نانوحبابها در سلولهاي سرطاني بسيار پايينتر از مقدار آن براي سلولهاي سالم است.
اين پژوهشگران، جزئيات نتايج کار تحقيقاتي خود را در مجلهي «Biamaterials» منتشر کردهاند.
جوانسازي قلبهاي پير با سلولهاي بنيادي اصلاح شده
جوانسازي قلبهاي پير با سلولهاي بنيادي اصلاح شده
محققان دانشگاه سانديگو با استفاده از سلولهاي بنيادي اصلاحشده موفق به جوانسازي مجدد بافتهاي آسيبديده و پير قلب در بيماران سكته قلبي كهنسال شدهاند.
به گزارش سرويس علمي خبرگزاري دانشجويان ايران(ايسنا)،اين پژوهش كه در مجله American College of Cardiology منتشر شده، در آينده ميتواند به درمانهاي جديد براي بيماران سكته قلبي منجر شود.
برخي از بيماران سكته قلبي معمولا از سن بالايي برخوردار بوده و سلولهاي بنيادي قلبی آنها زياد سالم نيست از اين رو دانشمندان اين سلولهاي بافتبرداري شده را اصلاح و آنها را سالمتر كردند.
اين سلولهاي بنيادي توسط پروتئين PIM-1 اصلاح شدند كه بقا و رشد سلول را ارتقا ميبخشد.
سلولهاي قلبي هنگامي كه سلولهاي بنيادي اصلاح شده بر فعاليت آنزيم تلومراز تاثير گذاشتند، جوانتر و سالمتر شدند. تلومرازها در حقيقت سرپوشهايي در انتهاي كروموزومها هستند كه تكثير سلولي را تسهيل ميكنند. پيري و بيماري در پي تجزيه اين تلومرازها ايجاد ميشوند.
اين شيوه به افزايش بلندي تلومراز و فعاليت آن پرداخته و همچنين تكثير سلولهاي بنيادي قلب را افزايش داد كه راههاي حياتي در مبارزه با سكته قلبي به شمار مي روند.
اين آزمايشات بر روي موشها و خوكها انجام شده و محققان دريافتند كه بلندترشدن تلومراز طي چهار هفته به رشد يك بافت جديد در قلب منجر ميشود.
جوانسازي قلبهاي پير با سلولهاي بنيادي اصلاح شده
محققان دانشگاه سانديگو با استفاده از سلولهاي بنيادي اصلاحشده موفق به جوانسازي مجدد بافتهاي آسيبديده و پير قلب در بيماران سكته قلبي كهنسال شدهاند.
به گزارش سرويس علمي خبرگزاري دانشجويان ايران(ايسنا)،اين پژوهش كه در مجله American College of Cardiology منتشر شده، در آينده ميتواند به درمانهاي جديد براي بيماران سكته قلبي منجر شود.
برخي از بيماران سكته قلبي معمولا از سن بالايي برخوردار بوده و سلولهاي بنيادي قلبی آنها زياد سالم نيست از اين رو دانشمندان اين سلولهاي بافتبرداري شده را اصلاح و آنها را سالمتر كردند.
اين سلولهاي بنيادي توسط پروتئين PIM-1 اصلاح شدند كه بقا و رشد سلول را ارتقا ميبخشد.
سلولهاي قلبي هنگامي كه سلولهاي بنيادي اصلاح شده بر فعاليت آنزيم تلومراز تاثير گذاشتند، جوانتر و سالمتر شدند. تلومرازها در حقيقت سرپوشهايي در انتهاي كروموزومها هستند كه تكثير سلولي را تسهيل ميكنند. پيري و بيماري در پي تجزيه اين تلومرازها ايجاد ميشوند.
اين شيوه به افزايش بلندي تلومراز و فعاليت آن پرداخته و همچنين تكثير سلولهاي بنيادي قلب را افزايش داد كه راههاي حياتي در مبارزه با سكته قلبي به شمار مي روند.
اين آزمايشات بر روي موشها و خوكها انجام شده و محققان دريافتند كه بلندترشدن تلومراز طي چهار هفته به رشد يك بافت جديد در قلب منجر ميشود.
| کشف مولکولی برای تولید سلولهای قلبی از سلولهای بنیادی |
| دانشمندان مولکولی را کشف کرده اند که می توان از آن برای تولید تعداد نامحدودی از سلول های جدید قلبی از سلول های بنیادی استفاده کرد. |
| به گزارش خبرگزاری مهر، محققان آمریکایی مجموعه بزرگی از مواد شبه دارو را بررسی کرده و دریافتند مولکول ITD-1 می تواند سلول های جدید قلبی را از سلول های بنیادی تولید کند. در این تحقیق از فناوری روباتیک پیچیده برای آزمایش مجموعه بزرگی از مواد شیمیایی شبه دارویی استفاده شد که زمانی به سلول های بنیادی اضافه و موجب کاردیومیسیت (تولید سلول های جدید قلبی) می شوند. مارک مرکوا مدیر برنامه توسعه و تولید عضلانی و مجری این تحقیقات گفت: تنها راه برای جایگزینی موثر سلول های عضلانی از بین رفته قلبی پیوند یک قلب جدید است. تولید بافت جدید عضلانی قلب از سلول های بنیادی با استفاده از دارو می تواند بسیار مناسب تر و جذاب تر از پیوند قلب باشد. نتایج این تحقیقات که توسط مرکز پزشکی استنفورد – برنهام انجام شده است در نشریه سلول های بنیادی منتشر شده است. |
تيمي از دانشمندان دانشگاه كاليفرنيا با تركيب يك دوربين فوق سريع و يك ميكروسكوپ نوري قدرتمند به همراه يك نرمافزار اميدوارند سلولهاي تومور سرطاني در حال گردش (CTCs) را كه در نمونههاي خون از تومورهاي سرطاني جدا شدهاند، شكار كنند.به گزارش سرويس علمي خبرگزاري دانشجويان ايران (ايسنا)، نرمافزار به كار برده شده در اين تكنيك قادر است دادههاي توليد شده با سرعت بالا توسط ميكروسكوپ و دوربين را پردازش كند.هنگام تشكيل يك تومور سرطاني در بدن، سلولها جدا شده و در جريان خون قرار ميگيرند. اين سلولهاي در حال گردش به سرطان كمك ميكنند كه در سراسر بدن پخش شود.آنها همچنين نشانه وجود سرطان هستند و پزشكان از طريق اين سلولها ميتوانند تشخيص دهند كه سرطان در جايي در بدن بيمار پنهان است.كشف اين CTCs بسيار چالشبرانگيز است زيرا نمونههاي خون شامل طيفي از گلبولهاي سفيد و قرمز، پلاكتها و ساير ذرات است و تعداد سلولهاي سرطاني در ميان آنها اندك است.تيم تحقيقاتي در تلاش براي غلبه بر اين معضل از دوربين ميكروسكوپي فوق سريع استفاده ميكند كه سالها قبل طراحي شده و قادر به ثبت تصاوير با سرعت شش ميليون فريم در ثانيه است.اين فناوري موسوم به STEAM از پالسهاي ليزري بينهايت كوتاه (يك ميلياردم ثانيه) براي تصويربرداري از نمونههاي خون استفاده ميكند.چنين تصويربرداري با نور سريع مستلزم پردازش بينهايت سريع است به طوري كه دوربين تيم علمي دادههاي دريافتي را گرفته و به رايانه ارسال ميكند. اين رايانه قادر است تصاوير را گردآوري و شكل به طور نامطلوب تعريف شده سلولهاي سرطاني را در مقابل شكل نرمال سلولهاي خون شناسايي كند.دانشمندان هماكنون در حال انجام آزمايشات باليني اين روند براي تشخيص سرطانهاي ريه، معده، پستان، پروستات و روده هستند. آنها اميدوارند به زودي سرطانهاي تخمدان و پانكراس را نيز به اين فهرست اضافه كنند. اين دو سرطان به سرعت گسترش يافته و شناسايي زودهنگام آنها از اهميت شاياني برخوردار است.چنانچه آزمايشات نتايج مطلوبي در پي داشته باشد، محققان به يك روش تشخيص غيرتهاجمي بدون درد دست يافتهاند كه امكان غربالگري سريع سرطانهاي مختلف طي يك ملاقات معمولي با پزشك را فراهم ميكند.
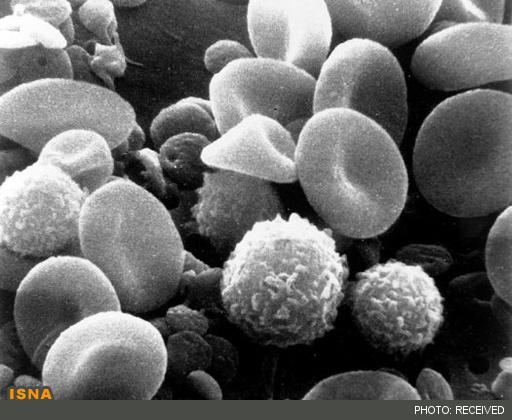

اميدهاي تازه براي درمان سرطان با رمزگشايي از يك پروتئين خاص
اميدهاي تازه براي درمان سرطان با رمزگشايي از يك پروتئين خاص
شيوه ابداعي محققان دانشگاه شفيلد در فرآيند رمزگشايي از پروتئين TREX مي تواند نويد دهنده درمان هاي جديد براي طيف گسترده اي از بيماري هاي مزمن از جمله انواع مختلف سرطان باشد.
به گزارش سرويس علمي خبرگزاري دانشجويان ايران (ايسنا)، محققان دپارتمان بيوتكنولوژي و زيست شناسي مولكولي دانشگاه شفيلد با همكاري محققان دانشكده پزشكي هاروارد در تحقيقات خود نشان دادند كه چگونه مجموعه پيچيده اي از پروتئين هاي موسوم به TREX به عنوان كليدي براي انتقال نقشه هاي سلول براي توليد پروتئين هاي حياتي بدن عمل مي كنند.
محققان معتقدند كه درك بهتر اين عملكرد به معني حل قطعي مشكل در فرآيندي است كه باعث بروز بيماري هاي مختلف مانند نورون حركتي، ديستروفي عضلاني و انواع مختلف سرطان مي شود.
پروفسور «استوارت ويلسون» سرپرست تيم تحقيقاتي تأكيد مي كند: توليد پروتئين بخش مهمي از زندگي موجودات است. اين فرآيند شامل خواندن كد در ژن ها و تبديل آن به پيامي است كه در نهايت به رمز گشايي براي توليد پروتئين منجر مي شود.
پيام از يك مولكول خاص به نام mRNA ساخته شده است؛ در تمام موجودات زنده اعم از مخمر تا انسان اين مولكول در يك محفظه در سلول به نام هسته ساخته مي شود، اما پس از توليد به يك محفظه جداگانه به نام سيتوپلاسم منتقل مي شود كه در آنجا كار رمزگشايي و توليد پروتئين انجام مي شود.
محققان نشان دادند كه پروتئين هايي به نام TREX يك علامت بر روي مولكول mRNA ايجاد مي كنند كه مانند يك كليد براي باز كردن پروتئين ناقل Nxf1 عمل كرده و اجازه مي دهد كه بر روي مولكول mRNA قرار گرفته و آن را به سيتوپلاسم براي توليد پروتئين حمل كند.
انتقال mRNA يك فرآيند حياتي براي موجود زنده محسوب مي شود و نقص در اين عملكرد منجر به بروز بيماري هاي مختلف مانند نورون حركتي و انواع مختلف سرطان مي شود.
اميدهاي تازه براي درمان سرطان با رمزگشايي از يك پروتئين خاص
شيوه ابداعي محققان دانشگاه شفيلد در فرآيند رمزگشايي از پروتئين TREX مي تواند نويد دهنده درمان هاي جديد براي طيف گسترده اي از بيماري هاي مزمن از جمله انواع مختلف سرطان باشد.
به گزارش سرويس علمي خبرگزاري دانشجويان ايران (ايسنا)، محققان دپارتمان بيوتكنولوژي و زيست شناسي مولكولي دانشگاه شفيلد با همكاري محققان دانشكده پزشكي هاروارد در تحقيقات خود نشان دادند كه چگونه مجموعه پيچيده اي از پروتئين هاي موسوم به TREX به عنوان كليدي براي انتقال نقشه هاي سلول براي توليد پروتئين هاي حياتي بدن عمل مي كنند.
محققان معتقدند كه درك بهتر اين عملكرد به معني حل قطعي مشكل در فرآيندي است كه باعث بروز بيماري هاي مختلف مانند نورون حركتي، ديستروفي عضلاني و انواع مختلف سرطان مي شود.
پروفسور «استوارت ويلسون» سرپرست تيم تحقيقاتي تأكيد مي كند: توليد پروتئين بخش مهمي از زندگي موجودات است. اين فرآيند شامل خواندن كد در ژن ها و تبديل آن به پيامي است كه در نهايت به رمز گشايي براي توليد پروتئين منجر مي شود.
پيام از يك مولكول خاص به نام mRNA ساخته شده است؛ در تمام موجودات زنده اعم از مخمر تا انسان اين مولكول در يك محفظه در سلول به نام هسته ساخته مي شود، اما پس از توليد به يك محفظه جداگانه به نام سيتوپلاسم منتقل مي شود كه در آنجا كار رمزگشايي و توليد پروتئين انجام مي شود.
محققان نشان دادند كه پروتئين هايي به نام TREX يك علامت بر روي مولكول mRNA ايجاد مي كنند كه مانند يك كليد براي باز كردن پروتئين ناقل Nxf1 عمل كرده و اجازه مي دهد كه بر روي مولكول mRNA قرار گرفته و آن را به سيتوپلاسم براي توليد پروتئين حمل كند.
انتقال mRNA يك فرآيند حياتي براي موجود زنده محسوب مي شود و نقص در اين عملكرد منجر به بروز بيماري هاي مختلف مانند نورون حركتي و انواع مختلف سرطان مي شود.
تبديل گلبولهاي قرمز خون به سلول بنيادي
تبديل گلبولهاي قرمز خون به سلول بنيادي
دانشمندان دانشگاه «جانز هاپكينز» موفق به ابداع يك شيوه مطمئن براي به عقب برگرداندن زمان براي سلولهاي خوني و بازيابي آنها به حالت ابتدايي سلول بنيادي شدند كه به آنها قابليت تبديل به تمام انواع سلولهاي بدن را ميدهد.
به گزارش سرويس علمي خبرگزاري دانشجويان ايران(ايسنا)، اين پژوهش كه در مجله PloS منتشر شده، بخش دومي در يك تلاش دنبالهدار براي تبديل موثر و مداوم سلولهاي خوني بالغ (گلبول قرمز خون) به سلولهاي بنيادي است كه براي كاربردهاي كلينيكي و تحقيقاتي به جاي سلولهاي بنيادي جنيني انسان بسيار واجد شرايط هستند.
اين محققان اكنون در آخرين تجريبات خود از شيوههايي براي تبديل سلولهاي خون بالغ به سلولهاي بنيادي القايي شبه جنيني استفاده كردهاند.
اين سلولهاي بالغ به صورت يك حالت شبه جنيني برنامهريزي شدهاند كه بر مشكل دائمي دانشمندان براي كار بر روي اين سلولها در آزمايشگاه غلبه كرده است.
در كل از ميان هر چند صد سلول خوني تنها يك يا دو سلول ممكن است به سلولهاي بنيادي القايي شبه جنيني تبديل شوند. اين محققان با شيوه جديد خود توانستند تا 60 درصد سلولها را به اين حالت تبديل كنند. آنها همچنين موفق به كشف يك ميانبر براي استفاده از ويروسها براي انتقال سلولهاي خون به حالت بنيادي شدند.
در حالت سنتي، دانشمندان از ويروسها براي انتقال بستههاي ژنتيكي به سلولها براي آغاز فرآيندهايي استفاده ميكنند كه سلول را از يك شكل(براي مثال پوست يا خون) به حالتهاي سلول بنيادي تبديل ميكنند. با اين حال ويروسهاي مورد استفاده در اين شيوه قادر به انجام جهش در ژنها و آغاز سرطان در سلولهاي انتقال يافته جديد هستند.
براي انتقال يك ژن بدون استفاده از ويروس، اين محققان از پلاسميدها يا حلقههاي دياناي استفاده كردهاند كه به طور خلاصه درون سلولها تكثير شده و سپس تنزل پيدا ميكنند.
همچنين يك گام جديد ديگر در اين سلولهاي خوني انجام شد كه در آن اين سلولها با محيط طبيعي مغز استخوان تحريك شدند. براي اين پژوهش، محققان جانز هاپكينز از سلولهاي خون بند ناف استفاده كرده، آنها را با عوامل رشد پرورش داده و از پلاسميدها براي انتقال چهار ژن به آنها استفاده كردند.
اين دانشمندان سپس يك پالس الكتريكي را به سلولها وارد كردند كه با ايجاد سوراخهاي ريزي در سطح، راه پلاسميدها را براي ورود به سلول باز كردند.
اين حلقههاي ريز دياناي به محض ورود، سلول را براي تبديل يه يك حالت ابتداييتر تحت تاثير قرار ميدادند.
تيم محققان در گام بعدي چند سلول تحت درمان قرار گرفته را به طور جداگانه و برخي ديگر را با سلولهاي مغز استخوان تحت تابش در يك ظرف آزمايشگاهي پرورش دادند.
دانشمندان در تحقيقات خود براي مقايسه سلولهاي پرورش يافته توسط شيوه گلبول قرمز خون با سلولهاي بنيادي القايي شبه جنيني از سلولهاي مو و پوست دريافتند كه سلولهاي بنيادي القايي كه از گلبولهاي خون درمان شده با چهار ژن و پرورش يافته با سلولهاي مغز استخوان به وجود آمدهاند، بسيار بهتر هستند.
اين پژوهشگران در تحقيقات جديد خود در حال آزمايش كيفيت سلولهاي بنيادي القايي جديد و قابليت آنها براي تبديل به سلولهاي ديگر در مقايسه با سلولهاي بنيادي القايي ايجاد شده توسط شيوههاي ديگر هستند.
شيوههاي كارآمد در توليد سلولهاي بنيادي القايي بدون ويروس ممكن است تحقيقات را براي ايجاد درمانهاي سلول بنيادي با استفاده از تقريبا تمام سلولها سرعت بخشيده و يك تصوير دقيقتر را از رشد سلولي و زيستشناسي ارائه دهد.
تبديل گلبولهاي قرمز خون به سلول بنيادي
دانشمندان دانشگاه «جانز هاپكينز» موفق به ابداع يك شيوه مطمئن براي به عقب برگرداندن زمان براي سلولهاي خوني و بازيابي آنها به حالت ابتدايي سلول بنيادي شدند كه به آنها قابليت تبديل به تمام انواع سلولهاي بدن را ميدهد.
به گزارش سرويس علمي خبرگزاري دانشجويان ايران(ايسنا)، اين پژوهش كه در مجله PloS منتشر شده، بخش دومي در يك تلاش دنبالهدار براي تبديل موثر و مداوم سلولهاي خوني بالغ (گلبول قرمز خون) به سلولهاي بنيادي است كه براي كاربردهاي كلينيكي و تحقيقاتي به جاي سلولهاي بنيادي جنيني انسان بسيار واجد شرايط هستند.
اين محققان اكنون در آخرين تجريبات خود از شيوههايي براي تبديل سلولهاي خون بالغ به سلولهاي بنيادي القايي شبه جنيني استفاده كردهاند.
اين سلولهاي بالغ به صورت يك حالت شبه جنيني برنامهريزي شدهاند كه بر مشكل دائمي دانشمندان براي كار بر روي اين سلولها در آزمايشگاه غلبه كرده است.
در كل از ميان هر چند صد سلول خوني تنها يك يا دو سلول ممكن است به سلولهاي بنيادي القايي شبه جنيني تبديل شوند. اين محققان با شيوه جديد خود توانستند تا 60 درصد سلولها را به اين حالت تبديل كنند. آنها همچنين موفق به كشف يك ميانبر براي استفاده از ويروسها براي انتقال سلولهاي خون به حالت بنيادي شدند.
در حالت سنتي، دانشمندان از ويروسها براي انتقال بستههاي ژنتيكي به سلولها براي آغاز فرآيندهايي استفاده ميكنند كه سلول را از يك شكل(براي مثال پوست يا خون) به حالتهاي سلول بنيادي تبديل ميكنند. با اين حال ويروسهاي مورد استفاده در اين شيوه قادر به انجام جهش در ژنها و آغاز سرطان در سلولهاي انتقال يافته جديد هستند.
براي انتقال يك ژن بدون استفاده از ويروس، اين محققان از پلاسميدها يا حلقههاي دياناي استفاده كردهاند كه به طور خلاصه درون سلولها تكثير شده و سپس تنزل پيدا ميكنند.
همچنين يك گام جديد ديگر در اين سلولهاي خوني انجام شد كه در آن اين سلولها با محيط طبيعي مغز استخوان تحريك شدند. براي اين پژوهش، محققان جانز هاپكينز از سلولهاي خون بند ناف استفاده كرده، آنها را با عوامل رشد پرورش داده و از پلاسميدها براي انتقال چهار ژن به آنها استفاده كردند.
اين دانشمندان سپس يك پالس الكتريكي را به سلولها وارد كردند كه با ايجاد سوراخهاي ريزي در سطح، راه پلاسميدها را براي ورود به سلول باز كردند.
اين حلقههاي ريز دياناي به محض ورود، سلول را براي تبديل يه يك حالت ابتداييتر تحت تاثير قرار ميدادند.
تيم محققان در گام بعدي چند سلول تحت درمان قرار گرفته را به طور جداگانه و برخي ديگر را با سلولهاي مغز استخوان تحت تابش در يك ظرف آزمايشگاهي پرورش دادند.
دانشمندان در تحقيقات خود براي مقايسه سلولهاي پرورش يافته توسط شيوه گلبول قرمز خون با سلولهاي بنيادي القايي شبه جنيني از سلولهاي مو و پوست دريافتند كه سلولهاي بنيادي القايي كه از گلبولهاي خون درمان شده با چهار ژن و پرورش يافته با سلولهاي مغز استخوان به وجود آمدهاند، بسيار بهتر هستند.
اين پژوهشگران در تحقيقات جديد خود در حال آزمايش كيفيت سلولهاي بنيادي القايي جديد و قابليت آنها براي تبديل به سلولهاي ديگر در مقايسه با سلولهاي بنيادي القايي ايجاد شده توسط شيوههاي ديگر هستند.
شيوههاي كارآمد در توليد سلولهاي بنيادي القايي بدون ويروس ممكن است تحقيقات را براي ايجاد درمانهاي سلول بنيادي با استفاده از تقريبا تمام سلولها سرعت بخشيده و يك تصوير دقيقتر را از رشد سلولي و زيستشناسي ارائه دهد.
كشف ژن مسؤول سرطان غيرارثي سينه
كشف ژن مسؤول سرطان غيرارثي سينه
تحقيقات صورت گرفته بر روي موشها نشان ميدهد كه جهش در ژن موسوم به NF1، عامل بروز يك چهارم سرطانهاي سينه غير ارثي است.
به گزارش سرويس علمي خبرگزاري دانشجويان ايران (ايسنا)، در تحقيقات قبلي شواهدي از نقش ژن NF1 در بروز انواع مختلف سرطان كشف شده بود و مطالعه اخير نقش اين ژن را در ايجاد سرطان سينه غير ارثي آشكار مي كند.
براي كشف نقش اين ژن در بروز سرطان سينه، ژنوم تومورهاي پستان در موش هاي مستعد ابتلا به ناپايداري ژنتيكي مورد تجزيه و تحليل قرار گرفته و محققان بروز جهش مشترك در تومورها را مورد بررسي قرار دادند.
فعاليت ژنوم تومورهاي سرطاني در موش تا حدود زيادي شبيه فعاليت در سلول سرطان سينه انسان هستند.
در 59 مورد از 60 تومور سرطاني هر دو نسخه ژن NF1 وجود نداشتند؛ اين ژن سركوبگر انكوژن Ras است كه فعاليت آن در غياب ژن NF1 بشدت افزايش مي يابد.
محققان با بررسي داده هاي اطلس ژنوم سرطان (TCGA) متوجه عدم حضور ژن NF1 در بيش از 25 درصد از موارد سرطان سينه زنان شدند و اين مسأله با كاهش در سطوح توليد ژن NF1 مرتبط است كه باعث افزايش فعاليت پروتئين Ras ميشود.
دكتر «جان شيمنتي» از محققان دانشگاه كورنل تأكيد مي كند: نتايج بدست آمده نشان مي دهد كه در بيماران مبتلا به سرطان سينه بايد ژن NF1 مورد توجه ويژه قرار گيرد و روش دارو درماني بايد در هر دو زمينه كاهش سرطان و پيشگيري از درمان هاي كمتر موثر تنظيم شود.
بر اين اساس، داروهاي مهار كننده فعاليت پروتئين Ras احتمالا براي مقابله با سرطان سينه ناشي از جهش ژن NF1 مفيد خواهند بود.
محققاني از دانشگاههاي كورنل، كاروليناي شمالي و مركز سرطان «اسلون کترینگ» نيويورك در اين پروژه تحقيقاتي مشاركت داشتهاند و نتيجه اين تحقيق در مجله GENETICS منتشر شده است.
كشف ژن مسؤول سرطان غيرارثي سينه
تحقيقات صورت گرفته بر روي موشها نشان ميدهد كه جهش در ژن موسوم به NF1، عامل بروز يك چهارم سرطانهاي سينه غير ارثي است.
به گزارش سرويس علمي خبرگزاري دانشجويان ايران (ايسنا)، در تحقيقات قبلي شواهدي از نقش ژن NF1 در بروز انواع مختلف سرطان كشف شده بود و مطالعه اخير نقش اين ژن را در ايجاد سرطان سينه غير ارثي آشكار مي كند.
براي كشف نقش اين ژن در بروز سرطان سينه، ژنوم تومورهاي پستان در موش هاي مستعد ابتلا به ناپايداري ژنتيكي مورد تجزيه و تحليل قرار گرفته و محققان بروز جهش مشترك در تومورها را مورد بررسي قرار دادند.
فعاليت ژنوم تومورهاي سرطاني در موش تا حدود زيادي شبيه فعاليت در سلول سرطان سينه انسان هستند.
در 59 مورد از 60 تومور سرطاني هر دو نسخه ژن NF1 وجود نداشتند؛ اين ژن سركوبگر انكوژن Ras است كه فعاليت آن در غياب ژن NF1 بشدت افزايش مي يابد.
محققان با بررسي داده هاي اطلس ژنوم سرطان (TCGA) متوجه عدم حضور ژن NF1 در بيش از 25 درصد از موارد سرطان سينه زنان شدند و اين مسأله با كاهش در سطوح توليد ژن NF1 مرتبط است كه باعث افزايش فعاليت پروتئين Ras ميشود.
دكتر «جان شيمنتي» از محققان دانشگاه كورنل تأكيد مي كند: نتايج بدست آمده نشان مي دهد كه در بيماران مبتلا به سرطان سينه بايد ژن NF1 مورد توجه ويژه قرار گيرد و روش دارو درماني بايد در هر دو زمينه كاهش سرطان و پيشگيري از درمان هاي كمتر موثر تنظيم شود.
بر اين اساس، داروهاي مهار كننده فعاليت پروتئين Ras احتمالا براي مقابله با سرطان سينه ناشي از جهش ژن NF1 مفيد خواهند بود.
محققاني از دانشگاههاي كورنل، كاروليناي شمالي و مركز سرطان «اسلون کترینگ» نيويورك در اين پروژه تحقيقاتي مشاركت داشتهاند و نتيجه اين تحقيق در مجله GENETICS منتشر شده است.
Similar threads
Similar threads
-
-
یافته های محققان ایرانی در باره تاثیر مكمل غذایی سلنیوم در پیش گیری از سرطان سینه
- شروع شده توسط silenta
- پاسخ ها: 0
-
-
طرح تزریق سلول بنیادی به بیماران مبتلا به 'ام .اس ' به زودی آغاز می شود
- شروع شده توسط mastane20
- پاسخ ها: 0
-
اولین پیوند با کمک یک اندام مصنوعی که از سلول های بنیادی خود بیمار تولید شده است انجام شد.
- شروع شده توسط plant_biology
- پاسخ ها: 0


