انواع لیگاندها
انواع لیگاند
1.لیگاندهای یک دندانه:فقط دارای یک اتم کئوردینه کننده است. هالیدها ، نیترات ، انواع آمینها ، سولفات و از مهمترین لیگندهای یک دندانه هستند.
2.لیگاندهای چند دندانه:این لیگاندها دارای یک یا چند اتم کئوردینه کننده هستند. این لیگاندها کمپلکسهای پایدارتری ایجاد میکنند و به کی سیلت یا شلاته کنندهها معروفند. یک کمپلکس میتواند به صورت آنیونی ، کاتیونی یا خنثی باشد.
--------------------------------------------------------------------------------
انواع لیگاند
· لیگاندهای یک دندانه:فقط دارای یک اتم کئوردینه کننده است. هالیدها ، نیترات ، انواع آمینها ، سولفات و از مهمترین لیگندهای یک دندانه هستند.
· لیگاندهای چند دندانه:این لیگندها دارای یک یا چند اتم کئوردینه کننده هستند. این لیگاندها کمپلکسهای پایدارتری ایجاد میکنند و به کی سیلت یا شلاته کنندهها معروفند. یک کمپلکس میتواند به صورت آنیونی ، کاتیونی یا خنثی باشد.
· ليگاند پل ساز : اين ليگند هم زمان به دو يا چند فلز مركزي متصل مي شود
· ليگاند دو سر دندانه : داراي دو اتم الكترون دهنده در ساختار خودش است كه در بعضي از شرايط از طريق يكي اتمها و در شرايط ديگر به اتم ديگر متصل مي شود.
--------------------------------------------------------------------------------
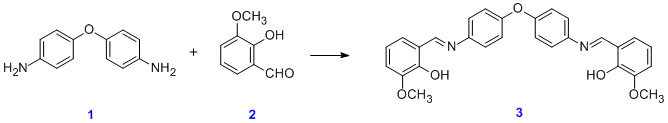
لیگاند (به انگلیسی: Ligand) در شیمی به مولکول و آنیونی گفته میشود که با یک فلز ترکیب کمپلکس دهد.
سابتهای فعال در لیگاند
تعداد سابتهای فعال در لیگاندها متغیر است. در شیمی معدنی لیگاند دارای چند سایت فعال برای حمله به یک فلز را لیگاند کیلات کننده مینامند.
در شیمی آلی فلزی لیگاندهای دو یا چند دندانه به سه شکل دانگل،کی لیت و یا پل به فلز متصل می شوند.
قدرت لیگاند
قدرت لیگاندهای مختلف در تشکیل پیوند با فلزات با هم تفاوت دارد. تفاوت قدرت لیگاندها باعث تفاوت در مقدار شکافتگی سطوح انرژی در فلز در اثر حضور لیگاند میشود. این مورد از مباحث نظریه میدان لیگاند است.
اثر قدرت لیگاند در ساختار ترکیبات کمپلکس
به دلیل تفاوت مقدار میدان لیگاندها ساختمان ترکیبات کمپلکس از هم متفاوت است. این ترکیبات میتوانند ساختاری هشت وجهی یا چهاروجهی داشته باشند.
نظریه میدان لیگاند
قدرت لیگاندهای مختلف در تشکیل پیوند شیمیایی با فلزات با هم تفاوت دارد. تفاوت قدرت لیگاندها باعث تفاوت در مقدار شکافتگی سطوح انرژی در فلز در اثر حضور لیگاند میشود. بر این اساس لیگاندها را به دو دسته لیگاند قوی و لیگاند ضعیف تقسیمبندی میکنند.
تعیین ساختار ترکیبات کمپلکس طبق نظریه میدان لیگاند
به دلیل تفاوت مقدار میدان لیگاندها ساختمان ترکیبات کمپلکس از هم متفاوت است. سطوح انرژی بین اربیتالهای مولکولی در این ترکیبات طبق قدرت لیگاند است و تغییر لیگاندها در ترکیبات کمپلکس میتواند باعث جابهجایی این سطوح انرژی شود. این ترکیبات میتوانند ساختاری هشت وجهی یا چهاروجهی داشته باشند.
--------------------------------------------------------------------------------
کمپلکس های آهن و اثر لیگاند در رنگ کمپلکس(با استفاده از نظریه میدان بلور)
برای تهیه آهن عنصری ، باید ناخالصیهای آن با روش کاهش شیمیایی از بین برود. آهن برای تولید فولاد بکار میرود که عنصر نیست، بلکه یک آلیاژ و مخلوطی است از فلزات متفاوت ( و تعدادی غیر فلز بخصوص کربن ). هسته اتمهای آهن دارای بیشترین نیروی همگیر در هر نوکلئون هستند بنابراین آهن با روش همجوشی ، سنگینترین و با روش شکافت اتمی ، سبکترین عنصری است که بصورت گرمازایی تولید میشود.
وقتی یک ستاره که دارای جرم کافی میباشد چنین کاری انجام دهد، دیگر قادر به تولید انرژی در هستهاش نبوده و یک ابر اختر پدید میآید. آهن رایجترین فلز در جهان به حساب میآید. الگوهای جهان شناختی با یک جهان باز پیشبینی زمانی را میکند که در نتیجه واکنشهای همجوشی و شکافت هسته ، همه چیز به آهن تبدیل خواهد شد! معمولترین حالات اکسیداسیون آهن عبارتند از:
· حالت فروس
· حالت فریک
· حالت فریلکه با تعدادی آنزیم ( مثلا" پیروکسیدازها ) پایدارشده است.
· آهن ( VI) هم معروف است (اگرچه کمیاب میباشد). درصورتیکه به شکل فرات پتاسیمباشد، ( K2FeO ) یکاکسیدکنندهانتخابی برای الکلهای نوع اول میباشد. این ماده جامد فقط در شرائط خلاءو ارغوانی تیره پایدار است، هم به صورت محلول سوزآور و هم بصورت یک ماده جامد.
· کاربید آهن Fe3C به نام سمنتیت معروف است
آهن بطور طبیعی دارای چهار ایزوتوپ پایدار Fe-54 , Fe56 , Fe-57 , Fe-58 میباشد. فراوانی نسبی ایزوتوپهای آهن در طبیعت تقریبا" Fe-54 8/5% ، Fe-56 7/91%، Fe-57 2/2% و Fe-58 3/0% است.Fe-60 که نوکلید پرتوزای غیر فعال است، دارای نیمه عمر 5,1 (Myr) میباشد. بیشتر تلاش گذشته برای اندازه گیری ترکیبات ایزوتوپی آهن بهعلتفرآیندهایی که توام با نوکلئوسنتز ( مانند مطالعات شهاب سنگها ) و شکلگیری کانیهاهستند، حول محور تعیین انواع مختلف Fe-60 صورت گرفته است.
در وهلههای مختلف، شهاب سنگهای Semarkona و Chervony Kut میتوان بین تمرکزNi-nickel|60 ( محصول اخترچه Fe-60 ) وفراوانی ایزوتوپهای پایدار آهن ارتباطی یافت که دلیلی برای وجود آهن 60 در زمانشکلگیری منظومه شمسی میباشد. احتمالا" انرژی آزاد شده توسط فروپاشی آهن 60 بههمراه انرژی رها شده بر اثر فروپاشی نوکلئید پرتوزای Al-26 ، در ذوب مجدد و تفکیکاخترچههای بعد از شکلگیری آنها 4,6 میلیارد سال پیش تاثیر داشته است. فراوانی Ni-60 موجود در مواد فرازمینی نیز ممکن است آگاهی بیشتری در مورد منشاءمنظومهشمسیو تاریخ ابتدایی آن ارائه نماید.
در بین ایزوتوپهای پایدار فقط آهن 57 دارای اسپین اتمی است،(2/1-). به همین خاطر آهن 57 در شیمی و بیوشیمی بعنوان یکایزوتوپ اسپینی دارای کاربرد است.
کمپلکس ها ترکیباتی هستند که در آن آنیون ها (یامولکول های خنثی) احاطه کننده یون فلزی بیشتر از تعدادی است که از ظرفیت عادی فلز انتظار می رود. مولکول ها یا یون هایی که یون فلز ی را احاطه می کنند لیگاند نامیده می شوند
یکی از مشخصات فلزات واسطه وجود ترکیبات رنگی در آن ها است.
رنگ اجسام نتیجه انعکاس یا جذب امواج الکترومغناطیس می باشد. اگر جسمی تمام طول موج های نور را جذب کند سیاه و اگر همه را منعکس کند سفید به نظر می رسد. اگر جسمی نور نارنجی را منعکس کند نارنجی دیده می شود و اگر فقط نور آبی را جذب کند باز هم نارنجی دیده می شود به همین خاطر رنگ آبی را مکمل نارنجی می نامند.
رنگ های مکمل را توسط دایره رنگ مشخص می کنند.
با توجه به اینکه بررسی رنگ در کمپلکس ها با نظریه میدان بلور توجیه می گردد ,به بیان مبانی این نظریه می پردازیم:
1) هنگامی که لیگاند به فلز نزدیک می شود و پیوندی بوجود می آید انرژی پتانسیل مجموعه (لیگاند و فلز ) کاهش می یابد.
2) با نزدیک شدن لیگاندها به یون فلزی نیروی دافعه ای بین لیگاند (جفت الکترون لیگاند) و الکترون های اوربیتال های d لیگاند بوجود می آید.
3) دافعه مزبور باعث می شود که سطح انرژی اوربیتال های d افزایش یابد اما این افزایش برای همه اوربیتال های d یکسان نیست بلکه بستگی به شکل هندسی کمپلکس دارد.
4) تقسیم اوربیتال d فلزی به اوربیتال های d کم انرژی و پرانرژی ، انشقاق میدان بلور نامیده می شود و اختلاف انرژی بین اوربیتال های d با Δ (دلتا) نشان داده می شود و به شکل هندسی کمپلکس وابسته است.
انرژی اوربیتال های d در یک کمپلکس چهاروجهی
انرژی اوربیتال های d در یک کمپلکس مربع مسطح
5) بزرگی شکاف میدان بلور (Δ) به نوع لیگاند بستگی دارد. لیگاند ها را بر حیب میزان Δ ای که ایجاد می کند ، لیگاندهای میدان ضعیف و میدان قوی تقسیم بندب می کنند و به آن سری طیف شیمیایی می گویند.
6) در یک میدان هشت وجهی اگر الکترونی در اوربیتال d کم انرژی قرار بگیرد به ازای هر الکترون به اندازه 0.4Δ انرژی پایداری میدان بلور CFSE بدست می آورد و اگر در اوربیتال های d پرانرژی قرار بگیرد به اندازه 0.6Δ ناپایداری ایجاد می کند.
اگر Δبه حد کافی بزرگ باشد می تواند انرژی لازم برای جفت شدن الکترون ها را تامین کند بنابراین لیگاندهای میدان قوی که Δ بزرگی دارند می توانند این کار را انجام بدهند و در نتیجه کمپلکس های کم اسپین ( مقدار الکترون فرد کم) ایجاد می کنند اما اگر Δ عدد کوچکی باشد یعنی لیگاند میدان ضعیف است بنابراین نمی تواند انرژی لازم برای جفت شدن الکترون ها را تامین کند در این صورت اوربیتال های d به صورت منفرد پر خواهند شد و کمپلکس پر اسپین ایجاد خواهند کرد.
اما در ارتباط با رنگ ترکیبات :
با تغییر نوع لیگاند فاصله اوربیتال های d تغییر می کند بنابراین میزان انرژی لازم برای انتقال الکترون از سطح انرژی پایین تر به بالاتر فرق می کند در نتیجه برحسب این که چه طول موج نوری برای ارتقا الکترون به سطح بالاتر جذب شود ، محصول رنگ خاص خود را خواهد داشت .
منبع : گرو اموزشی صنایع شیمیایی