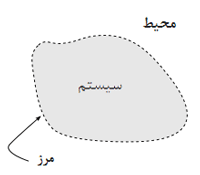
آنتروپی یک مفهوم شیمیایی است که توضیح دقیق آن قدری مشکل است؛
کلمه آنتروپی در جاهای دیگری هم کاربرد دارد، اما ما در این مقاله به بحث
ترمودینامیکی (علمی که راجع به گرما و تغییرات آن است) آن و فرایندهای
فیزیکی و شیمیایی می پردازیم.
آنتروپی چیست؟
ما انرژی را به صورت یک نیروی محرکه برای تغییرات تعریف می کنیم، آنتروپی
نیز به صورت نیروی محرکه ای برای تغییرات فیزیکی و شیمیایی (واکنش ها)
است. نماد آنتروپی (S) به انرژی مربوط می شود اما نوع دیگری از انرژی است.
تغییرات فیزیکی و شیمیایی که اندازه میگیریم، فقط با مفهوم انرژی نمیتوانند
توصیف شوند.
یک مفهوم متفاوت از اندازه گیری آنتروپی به تغییرات خود به خودی در سیستمی
مانند انبساط گاز در یک فضای خالی (خلأ) و انتقال گرما از یک جسم داغ به
جسمی سرد نیاز دارد.
این تغییرات باعث افزایش آنتروپی برای سیستمهای ذکر شده میشوند؛ اما انرژی
به درون یا بیرون از این سیستم ها انتقال پیدا نمی کند.
مفهوم آنتروپی به قانون های دوم و سوم ترمودینامیک مربوط است.
آنتروپی به توزیع انرژی حالت های انرژی مجموعه ای از مولکول ها مربوط است
و این جنبه از آنتروپی معولا در مکانیک آماری مورد بحث قرار می گیرد.
قانون دوم ترمودینامیک:
وقتی سیستمی مقدار انرژی q را در دمای ثابت T به دست می آورد، تغییرات
آنتروپیS با معادله زیر افزایش پیدا می کند:
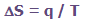
یعنی آنتروپی در هر مکانی، مقدار انرژی انتقال یافته تقسیم بر دما است.
بنابراین واحد آنتروپی، انرژی بر کلوین است (J× K[SUP]-1[/SUP] ).
با افزودن مقادیر کوچک آنتروپی در دماهای مختلف تخمین زده شود.
اگر دما به طور پیوسته تغییر کند، این جمع می تواند شکل انتگرالی به خود
بگیرد؛ با مفهوم انتگرال در درس دیفرانسیل آشنا شده اید.
افتاده اند، تنها به حالت اولیه و نهایی سیستم بستگی دارد.
البته فرض می شود که تغییرات در یک بازه زمانی طولانی اتفاق می افتند یا
در شرایط تقریبا تعادلی یا برگشت پذیر.
اگر تغییرات با سرعت زیاد در یک وضعیت برگشت ناپذیر اتفاق بیفتند، آنتروپی
مقدار بزرگ تر از آن چه که معین شده است، خواهد داشت؛ زیرا افزایش دما
یکنواخت نیست.
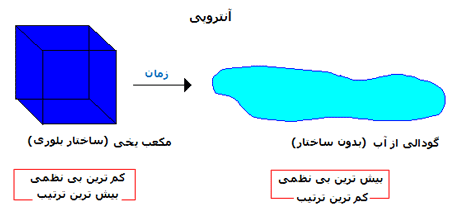
طبیعت، گرایش به افزایش آنتروپی S دارد و سیستم با همین گرایش، تغییر
می کند. این گونه تغییرات، فرایندهای خود به خودی نامیده می شوند. شاید
این جمله را شنیده باشید که جهان در حال انبساط است و گرایش به بی نظمی
دارد؛ این نشان می دهد که تمام انرژی های اطراف ما به صورتی از انرژی (که
گرما است) تبدیل می شوند که قابل برگشت نیست!
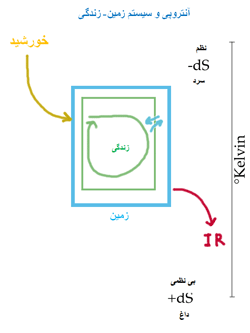
بنابراین نیروی محرک برای فرایند خودبخودی در یک سیستم منزوی (سیستمی
که با محیط بیرون خود، مبادله کار و گرما نداشته باشد) افزایش در آنتروپی
آن است.
این عبارت، یک بیان پذیرفته شده از قانون دوم ترمودینامیک است؛ البته از
صورت رسمی این جملات ناراحت نشوید، در ابتدا گفتیم که درک مفهوم
آنتروپی برای اکثر مردم سخت است!
قانون سوم ترمودینامیک:
طبق تعریف، تغییر آنتروپی می تواند با اندازه گیری مقدار انرژی انتقال یافته
برآورد شود.
آنتالپی موجود در یک سیستم یا در یک مول از ماده خالص، مقداری فرضی
و تئوری دارد که تمام گرماهای انتقال یافته به سیستم را از کم ترین دمای
ممکن٠ K در نظر می گیرد.
در صفر مطلق کلوین، ماده هیچ انرژی قابل انتقالی ندارد. ماده ای که در
کاملترین حالت بلوری منظم خود است و مولکول های آن شامل هیچ انرژی
ارتعاشی قابل انتقال، انرژی دورانی، انرژی انتقالی یا حتی انرژی اختلال
گرمایی نیستند.
وقتی انرژی q توسط ماده ای جذب می شود، دمای آن با dT افزایش پیدا
می کند. اگر ظرفیت گرمایی C باشد، پس:
q = C dT
پس ناحیه زیر منحنی q / T بر حسب T در دمای٠ K تا T ، آنتروپی مطلق S
سیستم است. البته ظرفیت گرمایی C هم ممکن است با دما تغییر کند.

در یک گذار یا انتقال فاز، گرما جذب می شود؛ اما دما ثابت باقی می ماند.
افزایش آنتروپی خواهد بود:

به یاد داشته باشید که مقادیر ترمودینامیکی در شرایط استاندارد، مقادیر
استاندارد نامیده می شوند؛ پس آنتروپی های S که در دمای T= ٢٩٨ K
یا همان دمای عادی اتاق برآورد میشوند، آنتروپیهای استاندارد نام دارند.
این مقادیر برای بسیاری از مواد به دقت اندازه گیری شده اند، برای برخی
مواد جامد، آنتروپی استاندارد مولی بر حسب J (K mol)-١ خواهد بود:

معمولا بالاتر است زیرا گرمای ذوب و گرمای تبخیر نیز باید در نظر گرفته
شود. آنتروپی های استاندارد مولار برای گازهای نجیب (همه در حالت
گازی و بر حسب J (K mol)-١ به صورت زیر است:
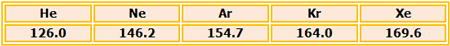
توجه کنید که آنتروپی با افزایش جرم اتمی زیاد می شود. این روند برای هالوژنها
نیز به همین ترتیب است؛اما آنتروپی برای چنین گازهای دواتمی بزرگتر از گازهای
تک اتمی نجیب است:


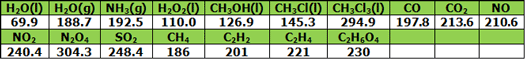
آنتروپی استاندارد برخی ترکیبات گازی و مایع نیز بر حسب J (K mol)-١ در
زیر محاسبه شده است:
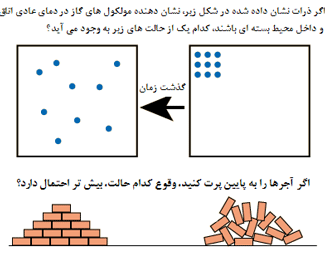
همواره احتمال بی نظمی، بیش تر از نظم است!










