جلوگيري از تشكيل رسوب
در اثر عبور آب خالص از غشاء، آب دور ريز با غلظت زياد (كه قادر به عبور از غشاء نيست) در پشت غشاء باقي ميماند. همزمان با عبور آب از ميان هر المنت، غلظت املاح آب تغليظ شده در غشاء افزايش مييابد و با انجام اين كار امكان دارد كه غلظت بعضي از نمكهاي حل شده به حد حلاليتشان برسد و رسوب تشكيل شود. مقدار زیاد ترسیب بر روی سطح غشاء میتواند سبب از بین رفتن کامل غشاء گردد. شستشوی شيميايي به موقع و مناسب و جلوگیری از فوق اشباع شدن نمکها، دو راه حل مطلوب در جلوگیری از ترسیب می باشند.
محاسبه پتانسيل تشكيل رسوب
نمكها در اثر يونيزه شدن در آب به اجزاي آنيوني و كاتيوني خود تبديل ميشوند. اگر غلظت نمك یعنی كاتيونها و آنيونهاي آن از میزان حلالیت آن نمك افزون شود، كريستال آن نمک تشکیل شده و ته نشین خواهد شد. اين كار در سيستم RO كه نمكها در سيستم تغليظ شدهاند، به راحتي اتفاق ميافتد.
حلاليت يك نمك به غلظت اجزاي تشكيل دهنده آن نمك، pH آب، دما و غلظت ساير نمكها در محلول بستگي دارد، روشهاي مختلفي وجود دارد تا حلاليت هر نمك به طور جداگانه مشخص شود. pH آب، دما و منابع آب جبراني موجب تغيير در حلاليت نمكهاي مخصوص ميشوند.
هنگام تحلیل و ارزیابی یک منبع آب خوراک از نظر احتمال تشکیل رسوب باید غلظت نمکهای کم محلول در جریان غلیظ یا دفعی سیستم RO مورد ارزیابی دقیق قرار گیرد. در صورت وجود یکی از آنها در شرایط فوق اشباع روشهای مناسب جلوگیری از ترسیب نمکها بکار گرفته شوند. معمولترین نمکهای کم محلول در آب عبارتند از:
فلزاتي نظير آهن (Fe+3) ، منیزیم (Mg+2) يا آلومينيم (Al+3) در لیست فوق آورده نشده اند. زیرا عملاً در همه موارد نمکهایشان غیر محلول هستند و چنانچه در آب خوراک یک سیستم RO وجود داشته باشد، بايد توسط فيلتر حذف شود تا از تهنشيني آنها برروي المنت غشاء جلوگيري شود.
محاسبه غلظت نمك در آب تغليظ شده RO
بيشترين پتانسيل تشكيل رسوب در بخشهایی از سیستم قرار دارد که غلظت نمکها در جریان تغليظ مقدار حداکثر خود را داشته باشد. با توجه به میزان بازدهی یک سیستم RO ، میزان تغلیظ از رابطه زیر محاسبه میشود:
غلظت نمکها یا TDS در جریان غلیظ سیستم از حاصل ضرب فاکتور تغلیظ در TDS یا غلظت نمکها در خوراک محاسبه ميشود. در حقیقت، غلظت نمكها در سطح غشاء تا چندین برابر غلظت آنها در جریان خوراک سیستم میباشد. با عبور جریان یا گذر جریان محصول از عرض غشاء یک غلظت بالاتر از نمکها (نسبت به غلظت نمکها در خوراک) روی سطح غشاء باقی میماند. چگونگی و میزان برگشت این نمکها به توده جریان آب خوراک با توجه به نسبت غلظت نمکها روی سطح غشاء به غلظت نمکها توده جریان تعیین خواهد شد. اين پديده، پلاريزاسيون غلظت ناميده ميشود. اين پارامتر مبین گراديان غلظت از سطح غشاء تا توده جریان بوده و علت آن سرعت کم نفوذ نمکهای جریان غلیظ از سطح غشاء به توده جریان می باشد.
كربنات كلسيم
یون بيكربنات (HCO3-) تقریباً در اكثر منابع آب طبيعي وجود دارد و این امر به دلیل توانايي آب در انحلال كربناتكلسيم از زمين و يا جذب CO2 از هوا میباشد. از آنجا که منابع آب طبيعي از لحاظ بيكربنات محلول در حد اشباع هستند، در نتيجه در سيستم RO به محض تغليظ آب، كربنات كلسيم از اولين نمكهايي خواهد بود كه رسوب ميكند.
شاخص اشباع لانجلير
پتانسيل رسوبدهي كربنات كلسيم با استفاده از ضريب اشباع لاِنجلير LSI قابل محاسبه است.
كه در آن pHs عبارت از pH آب در حالتي است كه از كربنات كلسيم اشباع شده است و طبق رابطه زير محاسبه ميشود.
براي تعيين غلظت CO2 در آب خوراك، رابطه بالا را ميتوان طبق فرمول زير بيان كرد.
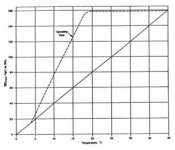
در pH هاي بالاتر از 3/8 ، غلظت CO2 محلول، ناچيز است. در pH بالا يون كربنات از بيكربنات تشكيل ميشود. نسبت بين غلظت بيكربنات (قليائيت متيل اورانژ) و غلظت كربنات (قليائيت فنل فنالين)، تابعي از pH است كه در شكل 4 نشان داده شده است.
در اثر عبور آب خالص از غشاء، آب دور ريز با غلظت زياد (كه قادر به عبور از غشاء نيست) در پشت غشاء باقي ميماند. همزمان با عبور آب از ميان هر المنت، غلظت املاح آب تغليظ شده در غشاء افزايش مييابد و با انجام اين كار امكان دارد كه غلظت بعضي از نمكهاي حل شده به حد حلاليتشان برسد و رسوب تشكيل شود. مقدار زیاد ترسیب بر روی سطح غشاء میتواند سبب از بین رفتن کامل غشاء گردد. شستشوی شيميايي به موقع و مناسب و جلوگیری از فوق اشباع شدن نمکها، دو راه حل مطلوب در جلوگیری از ترسیب می باشند.
محاسبه پتانسيل تشكيل رسوب
نمكها در اثر يونيزه شدن در آب به اجزاي آنيوني و كاتيوني خود تبديل ميشوند. اگر غلظت نمك یعنی كاتيونها و آنيونهاي آن از میزان حلالیت آن نمك افزون شود، كريستال آن نمک تشکیل شده و ته نشین خواهد شد. اين كار در سيستم RO كه نمكها در سيستم تغليظ شدهاند، به راحتي اتفاق ميافتد.
حلاليت يك نمك به غلظت اجزاي تشكيل دهنده آن نمك، pH آب، دما و غلظت ساير نمكها در محلول بستگي دارد، روشهاي مختلفي وجود دارد تا حلاليت هر نمك به طور جداگانه مشخص شود. pH آب، دما و منابع آب جبراني موجب تغيير در حلاليت نمكهاي مخصوص ميشوند.
هنگام تحلیل و ارزیابی یک منبع آب خوراک از نظر احتمال تشکیل رسوب باید غلظت نمکهای کم محلول در جریان غلیظ یا دفعی سیستم RO مورد ارزیابی دقیق قرار گیرد. در صورت وجود یکی از آنها در شرایط فوق اشباع روشهای مناسب جلوگیری از ترسیب نمکها بکار گرفته شوند. معمولترین نمکهای کم محلول در آب عبارتند از:
CaCo3 كربنات كلسيم | CaSO4 سولفات كلسيم | SrSO4 سولفات استرانسيوم |
BaSO4 سولفات باريم | CaF2 فلورايد كلسيم | Si(OH)4 سيليس |
CaSiO3 سيليكات كلسيم | MgSiO3 سيليكات منيزيم | FeSiO3 سيليكات آهن |
فلزاتي نظير آهن (Fe+3) ، منیزیم (Mg+2) يا آلومينيم (Al+3) در لیست فوق آورده نشده اند. زیرا عملاً در همه موارد نمکهایشان غیر محلول هستند و چنانچه در آب خوراک یک سیستم RO وجود داشته باشد، بايد توسط فيلتر حذف شود تا از تهنشيني آنها برروي المنت غشاء جلوگيري شود.
محاسبه غلظت نمك در آب تغليظ شده RO
بيشترين پتانسيل تشكيل رسوب در بخشهایی از سیستم قرار دارد که غلظت نمکها در جریان تغليظ مقدار حداکثر خود را داشته باشد. با توجه به میزان بازدهی یک سیستم RO ، میزان تغلیظ از رابطه زیر محاسبه میشود:
بازدهی = نرخ جریان محصول / نرخ جریان خوراک
(بازدهي – 1) ÷ 1 = فاکتور تغليظ
(بازدهي – 1) ÷ 1 = فاکتور تغليظ
غلظت نمکها یا TDS در جریان غلیظ سیستم از حاصل ضرب فاکتور تغلیظ در TDS یا غلظت نمکها در خوراک محاسبه ميشود. در حقیقت، غلظت نمكها در سطح غشاء تا چندین برابر غلظت آنها در جریان خوراک سیستم میباشد. با عبور جریان یا گذر جریان محصول از عرض غشاء یک غلظت بالاتر از نمکها (نسبت به غلظت نمکها در خوراک) روی سطح غشاء باقی میماند. چگونگی و میزان برگشت این نمکها به توده جریان آب خوراک با توجه به نسبت غلظت نمکها روی سطح غشاء به غلظت نمکها توده جریان تعیین خواهد شد. اين پديده، پلاريزاسيون غلظت ناميده ميشود. اين پارامتر مبین گراديان غلظت از سطح غشاء تا توده جریان بوده و علت آن سرعت کم نفوذ نمکهای جریان غلیظ از سطح غشاء به توده جریان می باشد.
كربنات كلسيم
یون بيكربنات (HCO3-) تقریباً در اكثر منابع آب طبيعي وجود دارد و این امر به دلیل توانايي آب در انحلال كربناتكلسيم از زمين و يا جذب CO2 از هوا میباشد. از آنجا که منابع آب طبيعي از لحاظ بيكربنات محلول در حد اشباع هستند، در نتيجه در سيستم RO به محض تغليظ آب، كربنات كلسيم از اولين نمكهايي خواهد بود كه رسوب ميكند.
شاخص اشباع لانجلير
پتانسيل رسوبدهي كربنات كلسيم با استفاده از ضريب اشباع لاِنجلير LSI قابل محاسبه است.
LSI = pH – pHs
كه در آن pHs عبارت از pH آب در حالتي است كه از كربنات كلسيم اشباع شده است و طبق رابطه زير محاسبه ميشود.
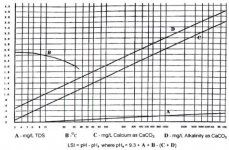
(pHs = (9.3 + A + B) – (C + D
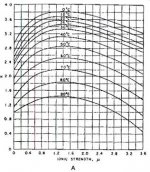
A = (log [TDS] – 1)/10
B= -13.12 Log10 (0C + 273) + 34.55
C = log10 [Ca+2 as Caco3] -0.4
[D = Log10 [Alkalinity as CaCo3
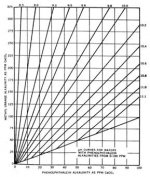
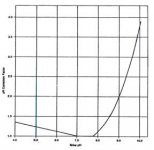
مقادير داخل كروشه برحسب غلظت مولي (moles/lit) است، به جز TDS كه برحسب (mg/lit) بيان ميشود. (مقادير A,B,C از شكل 2 نيز قابل محاسبه است). اگر ضريب لنجلير منفي باشد، نشان دهنده آن است كه آب، تمايلي به رسوب دهي ندارد. هرقدر ضريب لنجلير، عدد مثبت بزرگتري باشد پتانسيل رسوبدهي افزايش مييابد. با استفاده از ضريب لنجلير ميتوان حد مجاز غلظت نمكهاي آب تغليظ شده را (قبل از تشكيل رسوب) محاسبه كرد. از ضريب لنجلير براي تعيين قابليت خوردگي آب نيز ميتوان استفاده كرد. به عنوان مثال، هر چقدر ضريب لنجلير منفيتر شود، قابليت خورندگي آب بيشتر ميشود. pH آب تغليظ شده RO ، تابعي از قليائيت و غلظت CO2 در آن است؛ براي محاسبه pH در آب تغليظ شده، ابتدا لازم است غلظت CO2 در آب خوراك محاسبه شود. به خاطر اينكه گازهاي محلول نظير CO2 به راحتي از غشاء RO عبور ميكنند، غلظت گاز در آب تغليظ شده با غلظت آن در آب خوراك، يكسان است. pH اشباع با استفاده از غلظت CO2 و قليائيت آب تغليظ شده قابل محاسبه است. رابطه بين pH و نسبت قليائيت به CO2 در شكل 3 نشان داده شده است و توسط فرمول زير قابل محاسبه است.A = (log [TDS] – 1)/10
B= -13.12 Log10 (0C + 273) + 34.55
C = log10 [Ca+2 as Caco3] -0.4
[D = Log10 [Alkalinity as CaCo3
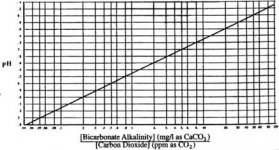
{[pH = 6.3 + Log10{[Alkalinity as CaCO3]/[CO2

مقادير شاخص لنجلير
براي تعيين غلظت CO2 در آب خوراك، رابطه بالا را ميتوان طبق فرمول زير بيان كرد.
(CO2] = [Alkalinity as CaCO3] ÷ 10(pH-6.3]
در pH هاي بالاتر از 3/8 ، غلظت CO2 محلول، ناچيز است. در pH بالا يون كربنات از بيكربنات تشكيل ميشود. نسبت بين غلظت بيكربنات (قليائيت متيل اورانژ) و غلظت كربنات (قليائيت فنل فنالين)، تابعي از pH است كه در شكل 4 نشان داده شده است.

رابطه بين قلياييت بيكربنات، دياكسيد كربن و pH