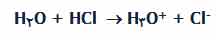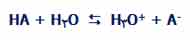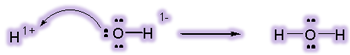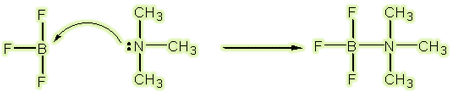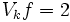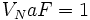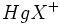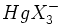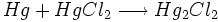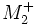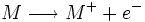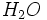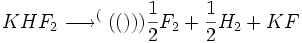تركيبات معدني تركيباتي هستند كه شامل هر دو عناصر كربن و هيدروژن نباشد.
بعبارت ديگر تركيباتي كه آلي نباشند در گروه تركيبات معدني دسته بندي ميشوند.
شيمي معدني شاخه بزرگي از علم شيمي است كه بطور كلي شامل بررسي،
تحليل و تفسير نظريه هاي خواص و واكنش هاي تمام عناصر و تركيبات آنها به جز
هيدروكربن ها و اغلب مشتقات آنها است.
اطلاعات مواد معدني در دسته بندي هاي اسيدها، بازها، نمك ها و عناصر ارائه
ميگردد.
1. اسيد :
بشر از دير باز با مفهوم ساده اسيد آشنايي داشته است. در حقيقت اين مواد، حتي
قبل از آنكه شيمي به صورت يك علم در آيد، شناخته شده بودند.
اسيدهاي آلي همچون سركه و آبليمو و آبغوره از قديم معروف بودند. اسيدهاي معمولي
مانند اسيد سولفوريك ، اسيد كلريدريك و اسيد نيتريك بوسيله كيمياگران قديم ساخته
شدند و بصورت محلول در آب بكار رفتند. براي مثال اسيد سولفوريك را جابربن حيان براي
نخستين بار از تقطير بلورهاي زاج سبز (FeSO4.7H2O) و حل كردن بخارات حاصل در آب،
بدست آورد.
در طي ساليان متمادي بر اساس تجربيات عملي لاووازيه (A.L.Lavoisier) چنين تلقي مي
گرديد كه اجزاء ساختمان عمومي كليه اسيدها از عنصر اكسيژن تشكيل گرديده است. اما
بتدريج اين موضوع از نظر علمي روشن و اعلام گرديد كه اگر اين موضوع صحت داشته باشد،
بر خلاف عقيده اعلام شده در مورد اكسيژن ، اين عنصر هيدروژن است. در حقيقت ، تعريف
يك اسيد بنا به فرمول اعلام شده از سوي ليبيگ (J. Von Liebig) در سال 1840 عبارت است
از: موادي حاوي هيدروژن كه ميتوانند با فلزات واكنش نموده و گاز هيدروژن توليد نمايند.
نظريه فوق مدت پنجاه سال مورد استناد بوده است. بعدها با پيشرفت علم شيمي ، مفاهيم
جديدي درباره اسيدها اعلام شده .
- نظريه آرنيوس درباره اسيدها
زمانيكه مفاهيم يونيزاسيون تركيبات شيميايي در محلولهاي آبي روشن گرديد، مفهوم اسيد
بطور قابل ملاحظهاي تغيير پيدا كرد.
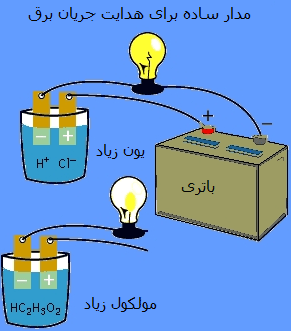
مطابق تعريف آرنيوس ، اسيد ماده ايست كه در آب يونيزه ميشود و يون +H3O كه گاهي
بصورت +H نيز نشان داده ميشود، توليد ميكند.
(HCl -----> H+ + Cl-(aq
آرنيوس قدرت اسيدي را نيز بر همين اساس تفسير كرد و گفت كه اسيد قوي ، در محلولهاي
آبي تقريبا، بطور كامل يونيزه ميشود. در صورتيكه كه ميزان تفكيك اسيد ضعيف كمتر است.
توجه كنيد كه مفهوم آرنيوس بر يونهاي آب استوار است. بر اساس تعريف آرنيوس ميتوان
نقش اكسيدهاي اسيدي را نيز تفسير كرد.
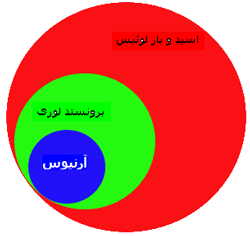
- نظريه برونشتد- لوري درباره اسيدها
در سال 1923، يوهان برونشتد و تامس لوري، مستقل از يكديگر مفهومي گستردهتر براي
اسيدها و بازها بيان كردند.
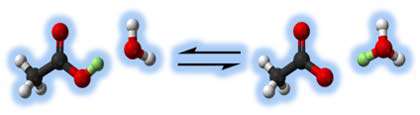
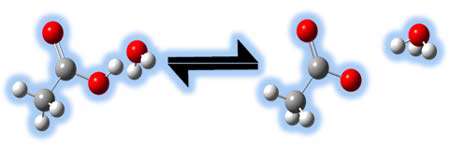
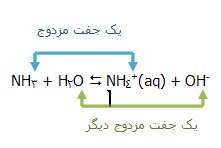
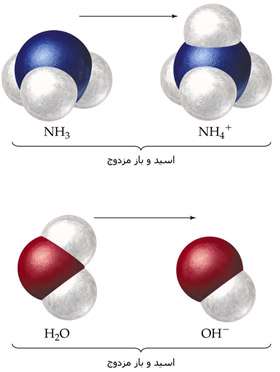
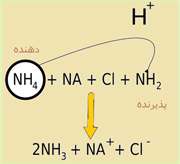
بر اساس تعريف ، برونشتد - لوري ، اسيد ماده اي است كه يك پروتون به باز ميدهد.
اسيدها ممكن است مولكول يا يون باشند.
با حذف پروتون، اسيد به باز (باز مزودج اسيد 1) تبديل ميشود و با گرفتن پروتون، باز اوليه،
يعني باز 2 به اسيد2 (اسيد مزدوج باز 2) تبديل ميشود.
اسيد 2 + باز 1 <----- اسيد 1 + باز 2
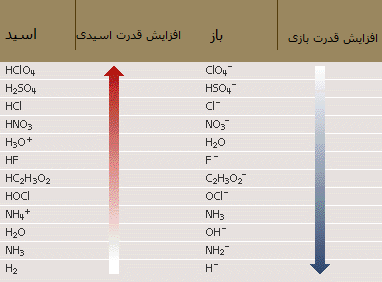
قدرت اسيدها ، بر ميل آنها براي از دست دادن يا گرفتن پروتون استوار است. هر چه اسيد
قويتر باشد، باز مزدوج آن ضعيفتر است. در يك واكنش ، تعادل در جهت تشكيل اسيد ضعيفتر
است.
اسيد پركلريك ، HClO4 ، قويترين اسيد است، و باز مزدوج آن ، يعني يون پركلرات ، -ClO4 ،
ضعيف ترين باز ميباشد و H2 ، ضعيفترين اسيد و باز مزدوج آن يعني يون هيدريد ، +H
قويترين باز ميباشد.
- نظريه لوييس درباره اسيدها
گيلبرت لوييس مفهوم گستردهتري براي اسيدها در سال 1938 پيشنهاد داد كه پديده اسيد -
باز را از پروتون رها ساخت.
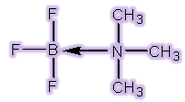
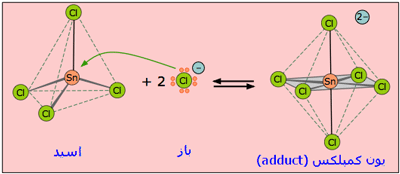
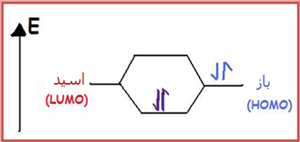
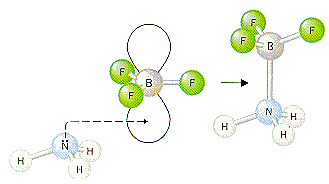
طبق تعريف لوييس ، اسيد مادهاي است كه بتواند با پذيرش يك زوج الكترون از باز ، يك پيوند
كوولانسي تشكيل دهد. در نظريه لوييس به مفهوم زوج الكترون و تشكيل پيوند كووالانسي
تاكيد ميشود.
تعريف لوييس در مورد اسيدها بسيار گستردهتر از آن است كه برونشتد عنوان نموده است.
تركيبات شيميايي كه ميتوانند نقش اسيد لوييس داشته باشند، عبارتند از:
مولكولها يا اتمهايي كه هشتتايي ناقص داشته باشند.
BH3 + F- → BH4-(aq
برخي اسيد هاي معدني :
اسيد كلريدريك
اسيد استيك
اسيد نيتريك
اسيد ترفتاليك
اسيد فسفريك
اسيد سولفوريك
سيليكاژل
2. باز :
در شيمي، يك باز رايجترين برداشت از مادّهاي محلول است كه ميتواند پروتونها را
بپذيرد. از باز بيشتر بعنوان يك قليايي نام ميبرند (تنها اگر يونهاي OH− در آن باشد).
اين موضوع به نظريهٔ برانستد-لوري در مورد اسيدها و بازها اشاره دارد. در تعريف ديگر،
باز به هر تركيب شيميايي گفته ميشود كه وقتي در آب حل شد، به آن pH بيشتر از
۷٫۰ بدهد.
سديم هيدروكسيد و آمونياك نمونههايي از بازهاي ساده هستند.
بازها را ميتوان متضادّ شيميايي اسيدها دانست. واكنش بين يك باز و يك اسيد را خنثي
سازي ميگويند. بازها و اسيدها با هم متضادّ هستند؛چون اسيدها، غلظت يون هيدرونيوم
(H3O+) را در آب افزايش ميدهند و بازها غلظت اين ماده را كاهش ميدهند.
بازها با اسيدها واكنش ميدهند تا آب و نمك (يا محلولهاي آنها) را توليد كنند.
در مفهوم آرنيوسي ، تركيبي است كه در آب تفكيك شده ، يون -OH بوجود ميآورد.
باز مانند : آمونياك
3. نمك ها :
در شيمي، نمك از كاتيون هاي مثبت و آنيون هاي منفي تشكيل شده، به طوري كه
نمك نهايي خنثي بوده و هيچ گونه بار مثبت يا منفي نداشته باشد. معمولاً در انواع
واكنش هاي شيميايي، نمك به عنوان يك فراورده فرعي توليد مي شود:
از واكنش اسيد با اكسيد فلز، نمك و آب تشكيل مي شود.
از واكنش باز «شيمي با اسيد، نمك و آب تشكيل مي شود.
از واكنش فلز با اسيد، نمك و هيدروژن تشكيل مي شود.
از واكنش اسيد با كربنات ها، نمك، آب و دي اكسيد كربن تشكيل مي شود.
در زندگي روزمره زمانيكه صحبت از نمك ميشود، منظورمان نمك آشپزخانه (كلريد سديم)
است.
نمك در قديم بسيار ارزش داشت، به طوري كه به سربازان به عنوان حقوق، نمك پرداخت
مي كردند.
نمك ها داراي اجزاي يوني مي باشند كه ايجاد بلور مي كنند. معمولاً در آب حل مي شوند
(چون يون هاي مثبت و منفي آنها در آب از هم جدا مي شوند). نمك ها نقطه ذوب بالايي
دارند و درجه سختي و قابليت تراكم آنها كم است. اگر نمك ذوب شود يا در آب حل شود،
هادي جريان الكتريسيته خواهد بود.
معمولاً نام نمك را بر حسب اجزاي تشكيل دهنده آن مي گذارند. جزء كاتيوني كه غالباً نام
يون فلز است به دنبال نام اجزاي آنيوني مي آيد. بنابراين ابتدا نام آنيون و سپس نام كاتيون
مي آيد. معمولاً آنيون ها را بر اساس اسيد اشتقاق شده از آن نام گذاري مي كنند:
استات ها، نمك هاي اسيد استيك هستند.
كربنات ها، نمك هاي اسيد كربنيك هستند.
كلريدها، نمك هاي اسيد هيدروكلريد هستند.
سيانيدها، نمك هاي اسيد هيدروسيانيك مي باشند.
نيترات ها، نمك هاي اسيد نيتريك مي باشند.
نيتريت ها، نمك هاي اسيد نيترو مي باشند.
فسفات ها، نمك هاي اسيد فسفريك هستند.
سولفات ها، نمك هاي اسيد سولفوريك هستند.
سيترات ها، نمك هاي اسيد سيتريك مي باشند.
برخي نمك هاي معدني :
نيترات آمونيوم
سولفات آمونيوم
جوش شيرين
هيپو كلريت سديم
سود سوز آور
سديم پيروسولفايت
جوهر نمك
4. عناصر :
عنصر شيميايي، در دانش شيمي، به مادهاي گفته ميشود كه اتمهاي آن تعداد پروتونهاي
برابر در هستهي خود داشته باشند. گاهي نيز براي سادگي، به عنصر شيميايي صرفاً عنصر
گفته ميشود. به تعداد پروتونهاي درون هستهٔ يك اتم، عدد اتمي گفته ميشود.
به عنوان مثال، تمام اتمهايي كه ۶ عدد پروتون در هستهٔ خود داشته باشند، عنصر شيميايي
كربن هستند بعبارتي ديگر عنصر مادهاي است كه به مواد خالص سادهتر از خود تجزيه نميشود.
برخي عناصر معدني :
سولفور
كلر
آرگون
هيدروژن
اكسيژن مايع
منگنز
اكسيژن
نيتروژن
فسفر